
| A、增加铜的用量 |
| B、增大压强 |
| C、隔绝空气加热 |
| D、增大硝酸的浓度 |
科目:高中化学 来源: 题型:
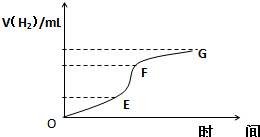 ( I)用纯净的锌粒与100mL2mol/L稀盐酸反应制取氢气,请回答:
( I)用纯净的锌粒与100mL2mol/L稀盐酸反应制取氢气,请回答:| 催化剂 |
| 500℃ |
| SO2 | O2 | SO3 | |
| 反应开始时的浓度/mol?L-1 | 3.0 | 1.5 | 0 |
| 10min后的浓度/mol?L-1 | |||
| 平均反应速率/mol?L-1?min-1 | 0.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba2+、Na+、SO42-、OH- |
| B、SO42-、Na+、H+、NO3- |
| C、H+、K+、Cl-、SO42- |
| D、Na+、K+、CO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 稀盐酸 |
B、 CuSO4溶液 |
C、 AgNO3 |
D、 CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A元素位于元素周期表中第二周期ⅥA族 |
| B、B离子与C离子具有相同的电子层结构 |
| C、C离子具有很强的还原性,B离子具有很强的氧化性 |
| D、B、C可以形成BC2型化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下11.2 L的甲烷气体含有甲烷分子数为0.5 NA个 |
| B、14g乙烯和丙烯的混合物中总原子数为3 NA个 |
| C、0.1 mol/L的氢氧化钠溶液中含钠离子数为0.1 NA个 |
| D、5.6 g铁与足量的稀硫酸反应失去电子数为0.3 NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状态下,33.6L氟化氢中含有氟原子的数目为1.5NA |
| B、在含有4mol Si-O键的石英晶体中,氧原子的数目为2NA个 |
| C、50mL18.4mol?L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
| D、某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com