


分析 X、Y、Z、M、N、Q、P为元素周期表前四周期的7种元素.X原子核外的M层中只有两对成对电子,外围电子排布为3s23p4,故X为S元素;Y原子核外的L层电子数是K层的两倍,L层电子数为4,则Y为C元素;Z元素原子核外共有3个能级,且最高能级电子数是前两个能级电子数之和,核外电子排布为1s22s22p4,故Z为O元素;M的内层电子数是最外层电子数的9倍,只能为第四周期元素,可推知M为Ca元素;N的原子序数比M小1,则N为K元素;Q在元素周期表的各元素中电负性最大,则Q为F元素;P元素的第三电子层处于全充满状态,第四电子层只有一个电子,原子核外电子数为2+8+18+1=29,故P为Cu,据此解答.
解答 解:
(11分)X、Y、Z、M、N、Q、P为元素周期表前四周期的7种元素.X原子核外的M层中只有两对成对电子,外围电子排布为3s23p4,故X为S元素;Y原子核外的L层电子数是K层的两倍,L层电子数为4,则Y为C元素;Z元素原子核外共有3个能级,且最高能级电子数是前两个能级电子数之和,核外电子排布为1s22s22p4,故Z为O元素;M的内层电子数是最外层电子数的9倍,只能为第四周期元素,可推知M为Ca元素;N的原子序数比M小1,则N为K元素;Q在元素周期表的各元素中电负性最大,则Q为F元素;P元素的第三电子层处于全充满状态,第四电子层只有一个电子,原子核外电子数为2+8+18+1=29,故P为Cu.
(1)P为Cu元素,属于ds区元素,Cu2+的核外电子排布式1s22s22p63s23p63d9,CO分子与氮气互为等电子体,二者结构相似,故CO电子式: ,
,
故答案为:ds;1s22s22p63s23p63d9; ;
;
(2)SO2分子中S原子价层电子对数为2+$\frac{6-2×3}{2}$=3,故VSEPR模型为平面三角形;
CO2分子中C原子形成2个σ键,没有孤对电子,碳原子杂化轨道类型为sp杂化;
H2O分子间能形成氢键,而H2S分子间不能形成氢键,故沸点H2O>H2S,
故答案为:平面三角形;sp;H2O分子间能形成氢键,而H2S分子间不能形成氢键;
(3)含有元素Ca、K等许多金属盐都可以发生焰色反应,其因是:电子由较高能级跃迁到较低能级时,以光的形式释放能量,
故答案为:电子由较高能级跃迁到较低能级时,以光的形式释放能量;
(4)同周期随原子序数增大第一电离能呈增大强酸、同主族自上而下第一电离能减小,故第一电离能:S<O<F,
故答案为:S<O<F;
(5)K为体心立方堆积,晶胞结构为图I,Cu为面心立方堆积,晶胞结构为图Ⅱ,晶胞中K原子配位数为8,而Cu原子配位数为12,K、Cu两种晶体晶胞中原子的配位数之比为8:12=2:3;
K的晶胞中原子数目为1+8×$\frac{1}{8}$=2,设该晶胞的密度为a g/cm3,阿伏加德罗常数的值为NA,N原子的摩尔质量为M,则晶胞体积为$\frac{\frac{2M}{{N}_{A}}g}{ag/c{m}^{3}}$=$\frac{2M}{a{N}_{A}}$cm3,设K原子半径为r,则(2r)2=3($\root{3}{\frac{2M}{a{N}_{A}}}$)2,故r=$\frac{{\sqrt{3}}}{4}\root{3}{{\frac{2M}{{a{N_A}}}}}$,
故答案为:2:3;$\frac{{\sqrt{3}}}{4}\root{3}{{\frac{2M}{{a{N_A}}}}}$.
点评 本题是对物质结构的考查,涉及核外电子排布、元素周期表、电子数、电离能、杂化方式、价层电子对互斥理论、等电子体、跃迁、晶胞结构与计算等,是对物质结构主干知识的综合考查,(5)中注意涉及常见晶胞结构,需要学生具备扎实的基础,难度中等.


科目:高中化学 来源: 题型:选择题
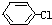 +NaOH→
+NaOH→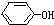 +NaCl,该反应的反应类型属于( )
+NaCl,该反应的反应类型属于( )| A. | 加成反应 | B. | 取代反应 | C. | 氧化还原反应 | D. | 置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
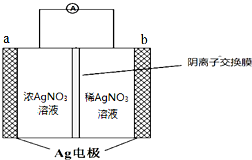 银是一种在工业、生活上有广泛用途的金属.
银是一种在工业、生活上有广泛用途的金属.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14C可用于文物年代的鉴定,14C与12C互为同素异形体 | |
| B. | PM 2.5亦称可入肺颗粒物,分散在空气中形成胶体,能吸附有毒有害物$\frac{2b}{a-2b}$质 | |
| C. | “海水淡化”可以解决“淡水供应危机”,向海水中加入净水剂明矾可以使海水淡化 | |
| D. | 绚丽缤纷的烟花中添加了含钾、钠、钙、钡等金属元素的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
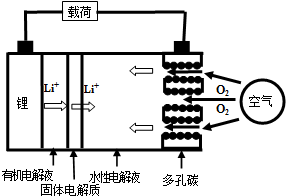
| A. | 放电时负极的电极反应式为:Li-e-=Li+ | |
| B. | 熔融的氢氧化锂用惰性电极电解再生时,金属锂在阴极得到 | |
| C. | 有机电解液可以是乙醇等无水有机物 | |
| D. | 放电时,正极的电极反应式为:2H2O+O2+4e-=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
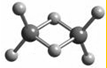 近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n,常用作还原剂 .已知最简单的氢铝化合物的化学式为Al2H6,它的熔点为150℃且熔融状态不能导电,燃烧时放出大量的热量.Al2H6的球棍模型如图所示.下列说法错误的是( )
近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n,常用作还原剂 .已知最简单的氢铝化合物的化学式为Al2H6,它的熔点为150℃且熔融状态不能导电,燃烧时放出大量的热量.Al2H6的球棍模型如图所示.下列说法错误的是( )| A. | Al2H6中Al为-3价,H为+1价 | |
| B. | Al2H6中含有离子键和极性共价键 | |
| C. | Al2H6在固态时所形成的晶体是分子晶体 | |
| D. | Al2H6在空气中完全燃烧,产物为氧化铝和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (3m+n)mol | B. | (3m+n+2p)mol | C. | (2.5m+0.5n-3p)mol | D. | (2.5m+0.5n)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝粉与烧碱溶液反应:Al+6OH+═[Al(OH)4]-+H2↑ | |
| B. | 水玻璃中加入稀盐酸:Na2SiO4+2H+═H2SiO3↓+2Na+ | |
| C. | 二氧化硅与苛性钠溶液反应:SiO2+2OH-═SiO32-+H2O | |
| D. | 将氯气通入到水中:Cl2+H2O═2HCl-+ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 定容时俯视 | B. | 容量瓶中原有少量的蒸馏水 | ||
| C. | 容量瓶盛过KOH溶液,使用前未洗涤 | D. | 转移时,不慎将液体流到瓶外 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com