
分析 (1)甲中浓硫酸吸收的是水、碱石灰吸收的是二氧化碳,最终CO燃烧生成二氧化碳,可以根据二者计算H、C原子个数比;乙中碱石灰吸收水和二氧化碳,CO还原CuO得到二氧化碳,但不能根据碱石灰增加的质量计算出C、H原子个数比;
(2)浓硫酸吸收水的物质的量=$\frac{2.52g}{18g/mol}$=0.14mol,碱石灰吸收二氧化碳的物质的量=$\frac{1.32g}{44g/mol}$=0.03mol,CO燃烧生成二氧化碳物质的量=$\frac{1.76g}{44g/mol}$=0.04mol,则二氧化碳分子个数和水中H原子个数之比为0.07mol:0.028mol=1:4,根据C、H原子个数比及状态判断物质;C、H原子个数被1:4,每个C原子最多形成4个C-H键.
解答 解:(1)甲中浓硫酸吸收的是水、碱石灰吸收的是二氧化碳,最终CO燃烧生成二氧化碳,可以根据水的物质的量、二氧化碳的物质的量计算H、C原子个数比,从而确定该物质化学式;
乙中碱石灰吸收水和二氧化碳,剩余的CO还原CuO得到二氧化碳,但不能根据碱石灰增加的质量计算出C、H原子个数比,所以乙不能确定该物质的最简式;
则甲可以求出A的最简式、乙不能求出A的最简式,
故答案为:甲;
(2)浓硫酸吸收水的物质的量=$\frac{2,.52g}{18g/mol}$=0.14mol,碱石灰吸收二氧化碳的物质的量=$\frac{1.32g}{44g/mol}$=0.03mol,CO燃烧生成二氧化碳物质的量=$\frac{1.76g}{44g/mol}$=0.04mol,则二氧化碳分子个数和水中H原子个数之比为0.07mol:0.028mol=1:4,其最简式为CH4,C、H原子个数被1:4,每个C原子最多形成4个C-H键,最简式中,H的含量已经达到最大值,所以不用测定其它数据,分子式为CH4,
故答案为:CH4.
点评 本题考查有机物推断,为高频考点,侧重于学生的分析能力和计算能力的考查,明确浓硫酸、碱石灰的性质是解本题关键,知道有机物中C原子成键特点,题目难度中等.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:解答题
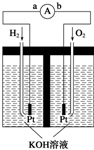 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
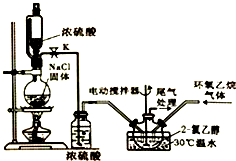 2-氯乙醇是一种重要的有机化工原料,受热时易分解.通常是以适量的2-氯乙醇为溶剂,用氯化氢与环氧乙烷反应制得新的2-氯乙醇.制取反应装置如图所示.
2-氯乙醇是一种重要的有机化工原料,受热时易分解.通常是以适量的2-氯乙醇为溶剂,用氯化氢与环氧乙烷反应制得新的2-氯乙醇.制取反应装置如图所示.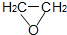 (g)+HCl(g)?ClCH2CH2OH(l)△H<0
(g)+HCl(g)?ClCH2CH2OH(l)△H<0| 化合物名称 | 相对分子质量 | 熔点(℃) | 沸点(℃) |
| 环氧乙烷 | 44 | -112,2 | 10.8 |
| 2-氯乙醇 | 80.5 | -67.5 | 128.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验方案(只要求填写选用试剂) | (1) | (2) |
| AlCl3溶液、MgCl2溶液、NaOH溶液 | 氯水、NaBr溶液 | |
| 实验现象 | 针对方程式①②或③试管中先生成白色沉淀,后白色沉淀消失. 针对方程式④:试管中有白色沉淀. | 溶液由浅黄绿色变成橙黄色 |
| 有关反应的离子方程式 | ①Al3++3OH-═Al(OH)3↓ ②Al(OH)3+OH-═AlO-2+H2O 或③Al3++4OH-═AlO-2+2H2O ④Mg2++2OH-═Mg(OH)2↓ | 2Br-+Cl2═Br2+2Cl- |
| 结论 | 金属性:Mg>Al | 非金属性:Cl>Br |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯分子中没有碳碳双键 | |
| B. | 淀粉、油脂、蛋白质都能水解,但水解产物不同 | |
| C. | 乙醇能与金属钠反应,乙酸也能与金属钠反应 | |
| D. | 乙烯和苯都能使溴水褪色,褪色的原因相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com