
【题目】下列说法正确的是
A.苯、油脂均不能使酸性KMnO4溶液褪色
B.乙烯和1,3-丁二烯互为同系物,它们均能使Br2水褪色
C.葡萄糖、果糖的分子式均为C6H12O6,二者互为同分异构休
D.乙醇、乙酸均能与Na反应放出H2,二者分子中官能团相同
 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
【题目】乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.下列说法正确的是( ) 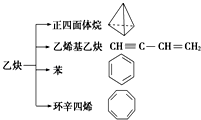
A.正四面体烷的分子式为C4H4 , 其二氯代物有两种
B.等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量相同
C.苯为平面六边形结构,分子中存在C﹣C和C═C,能使酸性KMnO4溶液褪色
D.环辛四烯跟苯的结构很像,不能使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙可以用于改善地表水质,处理含重金属粒子废水和治理赤潮,也可用于应急供氧等.工业上生产过氧化钙的主要流程如下: 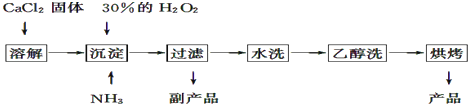
已知CaO28H2O呈白色,微溶于水,不溶于醇类和乙醚等,加热至350℃左右开始分解放出氧气.
(1)用上述方法制取CaO28H2O的化学方程式是;
(2)该制法的副产品为(填化学式),为了提高副产品的产率,结晶前要将溶液的pH调整到合适范围,可加入的试剂是;
(3)检验“水洗”是否合格的方法是;
(4)测定产品中CaO2的含量的实验步骤:
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入适量2molL﹣1的盐酸溶液,充分反应.
第二步:向上述锥形瓶中加入几滴淀粉溶液.
第三步:逐滴加入浓度为c molL﹣1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL.
已知:I2+2S2O32﹣═2I﹣+S4O62﹣
①第一步反应的离子方程式为;
②第三步中盛放Na2S2O3溶液的仪器名称是 , 反应完全时的现象为
③产品中CaO2的质量分数为(用字母表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的电化学装置中,电极I为Al,其他电极均为Cu,则下列说法正确的是( )
A.电子流向:电极Ⅳ→
B.→电极I
C.电极Ⅲ的电极反应:2H2O-4e-=4H++O2↑
D.电极Ⅱ的质量减少,电极Ⅲ的质量增加
E.三个烧杯中的SO42﹣浓度都始终保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,将体积为V L充满氨气的圆底烧瓶倒扣在含有足量水的水槽中(如图所示),实验完毕后立即将烧瓶从水槽中取出,所得溶液的密度为ρgcm﹣3 . 下列说法错误的是( ) 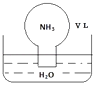
A.水最终会充满整个烧瓶
B.所得溶液的物质的量浓度为 ![]() molL﹣1
molL﹣1
C.所得溶液的质量分数为 ![]() ρ
ρ
D.将氨气换为二氧化氮,所得溶液的物质的量浓度也为 ![]() molL﹣1
molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食品安全已成为近几年来社会关注的热点问题之一。下列有关食品添加剂使用的说法正确的是( )
A.为了调节食品色泽,改善食品外观,使用工业色素苏丹红
B.为了提高奶粉中氮含量,加入适量的三聚氰胺
C.为了防止食品腐败,加入适量苯甲酸钠以达到阻抑细菌繁殖的作用
D.食盐是咸味剂,无防腐作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在四片玻璃片上分别滴有下列溶液,当氨气靠近各玻璃片时,有白烟产生的是( )
①浓硫酸 ②浓磷酸 ③浓硝酸 ④浓盐酸
A. ①② B. ①③ C. ②③④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是一个巨大的化学资源宝库,利用海水可以获得很多化工产品.
(1)海水中制得的氯化钠可用于生产烧碱及氯气.反应的离子方程式是 .
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去): ![]()
将Br2与Na2CO3反应的化学方程式补充完整:Br2+Na2CO3═NaBrO3++
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2 , 此外还含Fe2+、Fe3+、Mn2+等离子.以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去): 
生成氢氧化物沉淀的pH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH)2 | 9.6 | 11.1 |
①步骤②中需控制pH=9.8,其目的是 .
②用NaClO 氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是 .
③步骤③需在HCl保护气中加热进行,其原理涉及的离子方程式为 .
④NaClO还能除去盐卤中的CO(NH2)2 , 生成盐类物质和能参与大气循环的物质.除去0.1mol CO(NH2)2时消耗NaClOg.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com