
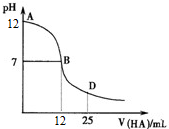
| A. | MOH在水中的电离方程式是MOH═M++OH- | |
| B. | 在B点表示酸碱恰好中和 | |
| C. | 随着盐酸的加入,溶液的导电能力逐渐增强(忽略体积变化) | |
| D. | 在D点时,存在c(OH-)>c(Na+)>c(Cl-)>c(M+) |
分析 常温下0.1mol•L-1 MOH溶液中pH=12,则c(OH-)=0.01mol/L,所以MOH在溶液中部分电离,即MOH为弱碱,
A.MOH在溶液中部分电离,用可逆号表示;
B.酸碱恰好反应生成强酸弱碱盐,在溶液中水解显酸性;
C.MOH为弱电解质,加盐酸产生MCl为强电解质,溶液中离子浓度增大;
D.25mL0.1mol•L-1 MOH溶液中逐滴滴加0.2mol•L-1 HCl溶液,当HCl的体积为25mL时,溶液中溶质为等物质的量的MCl和HCl,溶液显酸性.
解答 解:常温下0.1mol•L-1 MOH溶液中pH=12,则c(OH-)=0.01mol/L,所以MOH在溶液中部分电离,即MOH为弱碱,
A.MOH在溶液中部分电离,用可逆号表示,则电离方程式为:MOH?M++OH-,故A错误;
B.酸碱恰好反应生成强酸弱碱盐MCl,MCl在溶液中水解显酸性,B点表示的溶液的pH=7,溶液显中性,所以B点不是酸碱恰好中和的点,故B错误;
C.MOH为弱电解质,加盐酸产生MCl为强电解质,溶液中离子浓度增大,所以溶液的导电性增强,故C正确;
D.25mL0.1mol•L-1 MOH溶液中逐滴滴加0.2mol•L-1 HCl溶液,当HCl的体积为25mL时,溶液中溶质为等物质的量的MCl和HCl,溶液显酸性,则溶液中离子浓度关系为:c(Cl-)>c(H+)>c(M+)>c(OH-),故D错误.
故选C.
点评 本题考查了酸碱混合时的定性判断、离子浓度大小比较,注意根据酸溶液的pH和酸的浓度确定酸的强弱,为易错点,题目难度中等,明确图象曲线对应溶质组成为解答关键,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
 短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol•L-1r溶液的pH为2,s通常是难溶于水的混合物.上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol•L-1r溶液的pH为2,s通常是难溶于水的混合物.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 原子半径的大小W<X<Y | B. | 元素的非金属性Z>X>Y | ||
| C. | Y的氢化物常温常压下为液态 | D. | X的最高价氧化物的水化物为强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
| c/(mol•L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
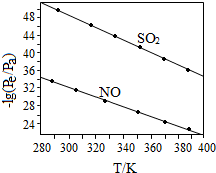
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验一 | 实验二 | |
| 装置 | 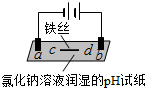 | 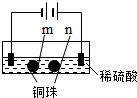 |
| 现象 | a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近有气泡产生;n处有气泡产生;… |
| A. | a、d处:2H2O+2e-═H2↑+2OH- | |
| B. | b处:2Cl--2e-═Cl2↑ | |
| C. | c处发生了反应:Fe-2e-═Fe2+ | |
| D. | 根据实验一的原理,实验二中m处能析出铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质水解的最终产物是氨基酸 | |
| B. | 氨基酸和蛋白质遇重金属离子均会变性 | |
| C. | α-氨基丙酸与α-氨基苯丙酸混合物脱水成肽,只生成2种二肽 | |
| D. | 氨基酸溶于过量氢氧化钠溶液中生成的离子,在电场作用下向负极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下浓硫酸能使铝发生钝化,可在常温下用铝制贮藏罐贮运浓硫酸 | |
| B. | 二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 | |
| C. | 次氯酸具有强氧化性,因此氯气可用于自来水的杀菌消毒 | |
| D. | 液氨汽化时要吸收大量的热,可用作制冷剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com