
已知丁烷燃烧热△H= -akJ /mol ,写出丁烷燃烧热的热化学方程式______________________________;完全燃烧一定量的丁烷,放出的热量为Q,已知为了完全吸收生成的CO2,消耗掉4mol/L NaOH溶液50mL ,则1mol丁烷完全燃烧放出的热量Q,的范围为______________________________。
科目:高中化学 来源: 题型:
(1)有人研究证明:使用氯气作自来水消毒剂,氯气会与水中有机物反应,生成如CHCl3等物质,这些物质可能是潜在的致癌致畸物质。目前人们已研发多种饮用水的新型消毒剂。下列物质不能作自来水消毒剂的是 (填序号)。
A.明矾 B.二氧化氯 C.臭氧 D.高铁酸钠( Na2FeO4)
(2)高铁(VI)酸盐是新一代水处理剂。其制备方法有:次氯酸盐氧化法(湿法)和高温过氧化物氧化法(干法)等。湿法是在碱性溶液中用次氯酸盐氧化铁(III)盐,写出该法的离子方程式: 。
(3)用高铁(VI)酸盐设计的高铁(VI)电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应:3Zn+2K2FeO4+8H2O→3Zn(OH)2+2Fe(OH)3+4KOH
①写出正极发生的电极反应式: 。
②用高铁(VI)电池作电源,以Fe作阳极,以Cu作阴极,对足量KOH溶液进行电解,当有0.1molK2FeO4反应时,在电解池中生成H2 L(标准状况),同时生成Fe(OH)3= mol。
③下表列出了某厂排放的含锌废水中的含量及国家环保标准值的有关数据:
| 含锌废水水质 | 经处理后的水国家环保标准值 | |
| Zn2+浓度/(mg·L-1) | ≤800 | ≤3.9 |
| pH | 1~5 | 6~9 |
经处理后的废水pH=8,此时废水中Zn2+的浓度为 mg/L(常温下,Ksp[Zn(OH)2]=1.2×10-17), (填“符合”或“不符合”)国家环保标准。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1) 常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入 0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
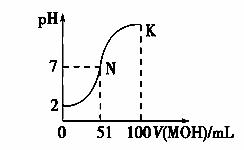
①由图中信息可知HA为________(填“强”或“弱”),理由是___________。
②常温下一定浓度的MA稀溶液的pH=a,则a________7(填“>”、“<”或“=”)。
③请写出K点所对应的溶液中离子浓度的大小关系: 。
(2)已知25 ℃时0.1 mol·L-1醋酸溶液的pH约为3,向其中加入醋酸钠晶体,等晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了c(OH-),因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。
①为了验证上述哪种解释正确,做如下实验:向0.1 mol·L-1的醋酸溶液中加入少量下列物质中的________(填写编号),然后测定溶液的pH。
A.固体CH3COOK B.固体CH3COONH4
C.气体NH3 D.固体NaHCO3
②若乙的解释正确,溶液的pH应________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
高温下2HBr(g) H2(g)+Br2(g); △H>0,达到平衡时,要使混合气体颜色加深,可采取的方法
H2(g)+Br2(g); △H>0,达到平衡时,要使混合气体颜色加深,可采取的方法
A.升高温度 B.缩小体积 C.减小压强 D. 增大H2浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,在一个2L的密闭容器中,加入4molA和2molB进行如下反应:
3A(g)+2B(g)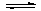 4C(?)+2D(?),反应一段时间后达到平衡,测得生成1.6molC,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是
4C(?)+2D(?),反应一段时间后达到平衡,测得生成1.6molC,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是
A.该反应的化学平衡常数表达式是K=
B.此时,B的平衡转化率是35%
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.增加C,B的平衡转化率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
现有A、B、C三种化合物,各取40 g相混合,完全反应后,得到18 g B、49 g C,还有D生成。已知D的相对分子质量为106。现将22 g A和11 g B反应,能生成D的物质的量是( )
A.1 mol B.0.5 mol
C.0.275 mol D.0.25 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
浓度为2 mol·L-1的NaOH溶液的正确含义是( )
A.在2 L水中溶有80 g NaOH B.80 g NaOH溶于水配成的溶液
C.1 L溶液中溶有80 g NaOH D.2 L溶液中溶有80 g NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
现有下列七种物质:①铝 ②蔗糖 ③CO2 ④H2SO4 ⑤Ba(OH)2
⑥红褐色的氢氧化铁胶体 ⑦HCl
(1)上述物质中属于电解质的有________。(填序号)
(2)向⑥的溶液中逐渐滴加⑦的溶液,看到的现象是________。
(3)上述物质中有两种物质在水溶液中发生反应,其离子方程式为:H++OH-====H2O,则该反应的化学方程式为____________________________________________。
(4)⑦的浓溶液与高锰酸钾发生反应的化学方程式为:2KMnO4+16HCl(浓)==== 2MnCl2+2KCl+5Cl2↑+8H2O,该反应中的氧化剂是________,盐酸的作用是 ____
________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com