
| A. | 电池反应的化学方程式为:CH3CH2OH+O2═CH3COOH+H2O | |
| B. | 检测时,电解质溶液中的 H+向负极移动 | |
| C. | 若有 0.4 mol 电子转移,则在标准状况下消耗 4.48 L 氧气 | |
| D. | 正极上发生的反应为:O2+4e-+2H2O═4OH- |
分析 酸性乙醇燃料电池的负极反应为:CH3CH2OH-4e-+H2O═CH3COOH+4H+,正极应为O2得电子被还原,电极反应式为:O2+4e-+4H+═2H2O,正负极相加可得电池的总反应式为:CH3CH2OH+O2═CH3COOH+H2O,可根据电极反应式判断离子和电子的转移问题.
解答 解:A.酸性乙醇燃料电池的负极反应为:CH3CH2OH-4e-+H2O═CH3COOH+4H+,可知乙醇被氧化生成乙酸和水,总反应式为:CH3CH2OH+O2═CH3COOH+H2O,故A正确;
B.原电池中,阳离子向正极移动,故B错误;
C.氧气得电子被还原,化合价由0价降低到-2价,若有0.4mol电子转移,则应有0.1mol氧气被还原,在标准状况下的体积为2.24L,故C错误;
D.燃料电池中,氧气在正极得电子被还原生成水,正极反应式为:O2+4e-+4H+═2H2O,故D错误.
故选:A.
点评 本题考查酸性乙醇燃料电池知识,题目难度中等,注意题中乙醇被氧化为乙酸的特点,答题中注意审题,根据题给信息解答.


科目:高中化学 来源: 题型:解答题
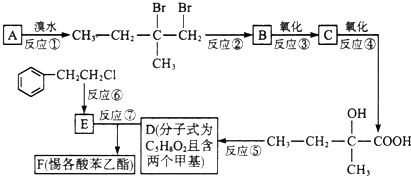
 ;F的结构简式为
;F的结构简式为 .
.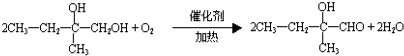 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用过量氨水吸收工业尾气中的SO2:2NH3•H2O+SO2═2NH4++SO32-+H2O | |
| B. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O | |
| C. | 向(NH4)2SO4溶液中加入适量Ba(OH)2:Ba2++SO42-═BaSO4↓ | |
| D. | 常温下,将铁片置于浓硝酸中:Fe+6HNO3═Fe(NO3)3+3NO2↑+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
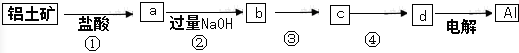
| A. | ①、②、③中除加试剂外,还需要进行过滤操作 | |
| B. | a、b中铝元素的化合价相同 | |
| C. | ③中需要通入过量的氨气 | |
| D. | ④进行的操作是加热,而且d一定是氧化铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 正极 | Zn | Cu | Cu | Zn |
| 负极 | Cu | Zn | Zn | Zn |
| 电解质溶液 | CuCl2 | H2SO4 | CuSO4 | CuCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol/L H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com