
【题目】某学习小组用如下图所示装置A、B分别探究金属铝与稀氢氧化钠溶液的反应,实验过程中装置A中烧杯内的溶液温度升高,装置B中烧杯的电流计指针发生偏转,请回答以下问题。

(1)装置A烧杯中反应的离子方程式为_________。
(2)装置B中Mg上的现象是_________,Al发生的电极反应式是__________________。
(3)当装置B导线中通过0.3mol电子时,装置B烧杯中溶液的质量变化为__________(填增重或减轻多少克)。
(4)该小组同学反思原电池的原理,其中观点正确的是_________(填字母序号)。
A.原电池反应的过程中一定有电子转移
B.原电池装置需要2个电极
C.电极一定不能参加反应
D.氧化反应和还原反应可以拆开在两极发生
E.原电池的正负极不仅与金属的活动性有关,而且也与电解质溶液有关
【答案】 2Al+2OH-+2H2O=2AlO2-+3H2↑ 有气泡冒出 Al-3e-+4OH-=AlO2-+2H2O 增重2.4g ABDE
【解析】试题分析:本题考查Al与NaOH溶液的反应,原电池的组成和工作原理,电极反应式的书写和化学计算。
(1)装置A烧杯中Al与NaOH溶液反应生成NaAlO2和H2,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,装置A烧杯中溶液温度升高说明Al与NaOH溶液的反应为放热反应。
(2)由于Mg与NaOH溶液不反应,装置B中Al为负极,Mg为正极,Mg极的电极反应式为2H2O+2e-=H2↑+2OH-,Mg上的现象是:有气泡冒出。Al为负极,Al发生的电极反应式为Al-3e-+4OH-=AlO2-+2H2O。
(3)装置B中电池总反应为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,可见当导线中通过6mol电子时,有2molAl溶解同时产生3molH2,溶液质量增重(2![]() 27-3
27-3![]() 2)g=48g;当装置B导线中通过0.3mol电子时,装置B烧杯中溶液增重
2)g=48g;当装置B导线中通过0.3mol电子时,装置B烧杯中溶液增重![]() 0.3mol=2.4g。
0.3mol=2.4g。
(4)A项,原电池是将化学能转化为电能的装置,原电池反应的过程中一定有电子转移,A项正确;B项,原电池装置需要2个电极,B项正确;C项,电极可以参加反应,如装置B中Al电极参与负极反应,C项错误;D项,在原电池中,氧化反应在负极发生,还原反应在正极发生,氧化反应和还原反应拆开在两极发生,D项正确;E项,Mg、Al和稀硫酸构成原电池时Mg为负极、Al为正极,Mg、Al和NaOH溶液构成原电池时Mg为正极、Al为负极,原电池的正负极不仅与金属的活动性有关,而且也与电解质溶液有关,E项正确;答案选ABDE。


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.7.8gNa2S和Na2O2的固体混合物中含有的阴离子数目为0.1NA
B.用铜做电极电解CuSO4溶液的反应方程式:2Cu2++2H2O ![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
C.等质量的N2和CO所含原子数均为2NA
D.pH等于2的醋酸溶液中加入0.01mol/L的盐酸,溶液pH会变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,1 molX和n mol Y在体积为2L的密闭容器中发生如下反应:X(g)+Y(g)=2Z(g)+M(s),5min后达到平衡,此时生成2a mol Z.下列说法正确的是( )
A.用X表示此反应的反应速率是(0.1﹣0.2a)mol(Lmin)﹣1
B.当混合气体的质量不再发生变化时,说明反应达到平衡状态
C.向平衡后的体系中加入1mol M,平衡向逆反应方向移动
D.向上述平衡体系中再充入1mol X,v(正)增大,v(逆)减小,平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一绝热(不与外界发生热交换)的恒容容器中,发生反应:2A(g)+B(s) ![]() C(g)+D(g),下列描述中能表明反应已达到平衡状态的有( )个
C(g)+D(g),下列描述中能表明反应已达到平衡状态的有( )个
①容器内温度不变 ②混合气体的密度不变 ③混合气体的压强不变
④混合气体的平均相对分子质量不变 ⑤C(g)的物质的量浓度不变
⑥容器内A、C、D三种气体的浓度之比为2:1:1 ⑦某时刻v(A)=2v(C)且不等于零
⑧单位时间内生成n mol D,同时生成2n mol A
A. 4 B. 5 C. 6 D. 7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向四个体积相同的密闭容器(甲、乙、丙、丁)中分别充入一定量的SO2和O2,开始反应时,按反应速率由大到小排列顺序正确的是( )
甲:在500℃时,10mol SO2和6mol O2反应
乙:在500℃时,用V2O5作催化剂,10mol SO2和5mol O2反应
丙:在500℃时,8mol SO2和5mol O2反应
丁:在450℃时,8mol SO2和5mol O2反应.
A. 乙、甲、丙、丁 B. 甲、乙、丙、丁
C. 乙、甲、丁、丙 D. 丁、丙、乙、甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
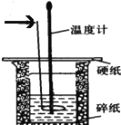
(1)箭头所指的仪器名称为______________________________。
(2)上图所示实验装置存在着一处错误,这处错误是_______________。
(3)若某同学实验中改用60 mL 0.50 mol·L-1稀硫酸跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量_______(填“相等”或“不相等”),所求中和热_______________(填“相等”或“不相等”)。
(4)若某同学用改正后的装置做实验,造成测得中和热的数值偏低,请你分析可能的原因是________。
A.做本实验的当天室温较低
B.在量取盐酸时俯视刻度线
C.在量取氢氧化钠溶液时仰视刻度线
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.测量盐酸的温度后,温度计没有用水冲洗干净就去测量氢氧化钠溶液的温度
F.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计了一个甲醇燃料电池,并用该电池电解200mL一定浓度的NaCl与CuSO4混合溶液,其装置如图1: 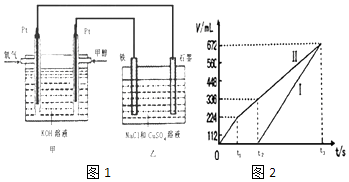
(1)写出甲中通入甲醇这一极的电极反应式 .
(2)理论上乙中两极所得气体的体积随时间变化的关系如图2所示(已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式,原混合溶液中NaCl的物质的量浓度为mol/L.(设溶液体积不变)
(3)当向上述甲装置中通入标况下的氧气336mL时,理论上在铁电极上可析出铜的质量为g.
(4)已知草酸H2C2O4为弱酸. ①常温下,下列事实能说明草酸是弱电解质的是 .
A.向草酸钠溶液加酚酞,溶液变红
B.取一定量草酸溶液加水稀释至10倍,pH变化小于1
C.草酸能使酸性KMnO4溶液褪色
D.取相同pH的草酸溶液和盐酸,分别加入足量的大小、形状相同的镁条,草酸溶液反应速度快
②常温下,0.1molL﹣1的草酸溶液与pH=13的NaOH溶液等体积混合,所得溶液的pH为6,则c(HC2O4)+2c(C2O42﹣)=(用准确的数学表达式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com