
【题目】ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题: ![]()
(1)S单质的常见形式为S8 , 其环状结构如下图所示,S原子采用的轨道杂化方式是;
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O,S,Se原子的第一电离能由大到小的顺序为;
(3)Se原子序数为 , 其核外M层电子的排布式为;
(4)H2Se的酸性比H2S(填“强”或“弱”).气态SeO3分子的立体构型为 , SO32﹣离子的立体构型为 .
【答案】
(1)sp3
(2)O>S>Se
(3)34;3s23p63d10
(4)强;平面三角形;三角锥形
【解析】解:(1)根据图片知,每个S原子含有2个σ键和2个孤电子对,所以每个S原子的价层电子对个数是4,则S原子为sp3杂化,所以答案是:sp3;(2)同一主族元素,元素原子失电子能力随着原子序数的增大而增强,原子失电子能力越强,其第一电离能越小,所以其第一电离能大小顺序是O>S>Se,所以答案是:O>S>Se;(3)Se元素34号元素,M电子层上有18个电子,分别位于3s、3p、3d能级上,所以其核外M层电子的排布式为3s23p63d10 , 所以答案是:34;3s23p63d10;(4)非金属性越强的元素,其与氢元素的结合能力越强,则其氢化物在水溶液中就越难电离,酸性就越弱,非金属性S>Se,所以H2Se的酸性比H2S强,气态SeO3分子中Se原子价层电子对个数是3且不含孤电子对,所以其立体构型为平面三角形,SO32﹣离子中S原子价层电子对个数=3+ ![]() ×(6+2﹣3×2)=4且含有一个孤电子对,所以其立体构型为三角锥形,所以答案是:强;平面三角形;三角锥形.
×(6+2﹣3×2)=4且含有一个孤电子对,所以其立体构型为三角锥形,所以答案是:强;平面三角形;三角锥形.


科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 王水是浓硝酸和浓盐酸按物质的量之比为1:3组成的混合物
B. pH小于5.6的雨水称为酸雨
C. 分散质粒子直径介于1nm~100nm之间的分散系称为胶体
D. 光导纤维的主要成分是SiO2,太阳能光电池板的主要成分是硅晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A,B,C,D四种短周期主族元素,它们的原子序数依次增大,其中A元素原子核外电子仅有一种原子轨道,也是宇宙中最丰富的元素,B元素原子的核外p轨道电子数比s轨道电子数少1,C为金属元素且原子核外p轨道电子数和s轨道电子数相等,D元素的原子核外所有p轨道全充满或半充满.
(1)写出C,D两种基态原子核外电子排布图:C;D .
(2)写出B元素单质和氢化物的电子式:单质 , 氢化物 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中二氧化硫、氮氧化物和可吸入颗粒物是雾霾主要组成.某课题组用汽车尾气为原料探究二氧化硫、氮氧化物的化学性质.
(1)I.汽车尾气(含有烃类、CO、SO2与NO等物质),冶理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂).它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的转化.写出一氧化碳与一氧化氮反应的化学方程式: Ⅱ.课题组欲在绿色环保的条件下探究大气污染物SO2的性质,设计如图实验装置.请回答: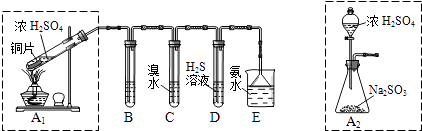
B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂为;C中反应的离子方程式为 .
(2)为了实现绿色环保的目标,制取SO2装置最好选择 . (A1或A2装置)用氨水吸收尾气中的SO2 , “吸收液”中可能含有OH﹣、SO32﹣、SO42﹣、HSO3﹣等阴离子.请回答:
(3)氨水吸收过量SO2的反应的离子方程式为
(4)已知亚硫酸氢盐一般易溶于水,SO2也易溶于水.现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2mol/L盐酸、2mol/LHNO3、1mol/LBaCl2溶液、l mol/LBa(OH)2溶液、品红溶液、蒸馏水.请设计实验证明“吸收液”中存在SO32﹣、HSO3﹣ , 完成下表的实验操作、预期现象和结论:
实验操作 | 预期现象与结论 |
步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取l mol/L BaCl2溶液向小烧杯滴加直至过量. | 若出现白色浑浊,则溶液中存在SO32﹣或 SO42﹣ . |
步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体 . |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.实验室制取乙烯时浓硫酸是催化剂和吸水剂
B.硝基苯制备时浓硫酸作催化剂和脱水剂
C.实验室制备乙烯、硝基苯、苯磺酸时均使用到温度计,且水银球在反应混合物液面以下
D.水浴加热的优点是可以受热均匀且便于控制温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A,B,C,D,E在元素周期表中的相对位置如图所示,下列说法正确的( ) 
A.原子半径的大小顺序为:rA>rB>rC>rD>rE
B.元素D的最高价氧化物对应的水化物的酸性比E的强
C.A,D两种元素在自然界中都存在相应的单质
D.C的最高价氧化物的水化物与E的最高价氧化物的水化物之间不能发生反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com