
| A. | O2分子间存在着非极性共价键 | |
| B. | CO2分子内存在着极性共价键 | |
| C. | SO2与H2O反应的产物是离子化合物 | |
| D. | 盐酸中含有H+和Cl-,故HCl为离子化合物 |
分析 A.分子间没有共价键;
B.不同非金属原子间存在极性共价键;
C.SO2与H2O反应生成亚硫酸,酸都是共价化合物;
D.HCl中Cl原子与H原子间通过共用电子对结合在一起.
解答 解:A.分子间没有共价键,分子间只存在分子间作用力,故A错误;
B.不同非金属原子间存在极性共价键,所以CO2分子内存在着极性共价键,故B正确;
C.SO2与H2O反应生成亚硫酸,酸都是共价化合物,所以亚硫酸不是离子化合物,故C错误;
D.HCl中Cl原子与H原子间通过共用电子对结合在一起,HCl属于共价化合物,故D错误.
故选B.
点评 本题考查了化学键,题目难度不大,注意把握共价键、离子键、共价化合物和离子化合物的区别,侧重于考查学生对基础知识的掌握情况.


科目:高中化学 来源: 题型:解答题
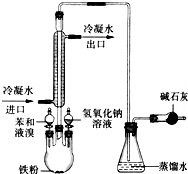 如图是实验室制取溴苯的装置图.
如图是实验室制取溴苯的装置图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
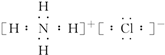 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
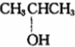 ⑨${\;}_{6}^{13}$C
⑨${\;}_{6}^{13}$C 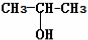 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L的戊烷所含的分子数为0.5NA | |
| B. | 28g乙烯所含共用电子对数目为5NA | |
| C. | 1 mol甲基的电子数目为7NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其所含原子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在周期表中,族序数都等于该族元素的最外层电子数 | |
| B. | 同一主族的两种元素的原子序数之差可能是44 | |
| C. | 卤素单质随原子序数的增大,其熔沸点逐渐降低 | |
| D. | 若R的含氧酸的酸性大于Q的含氧酸的酸性,则非金属性R大于Q |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
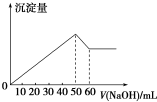 在AlCl3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中AlCl3与MgSO4的物质的量浓度之比为( )
在AlCl3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中AlCl3与MgSO4的物质的量浓度之比为( )| A. | 1:1 | B. | 3:1 | C. | 2:1 | D. | 1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①② | B. | 只有①④⑤ | C. | 只有②④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com