
【题目】下列反应中,生成物所贮的化学能比反应物所贮化学能要多的是( )
A.CaO+H2O=Ca(OH)2
B.NaOH+HCl=NaCl+H2O
C.CH4+2O2 ![]() CO2+2H2O
CO2+2H2O
D.CO2+C ![]() 2CO
2CO
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,可以进行综合利用。从海水中提取淡水、食盐和溴的过程如图:
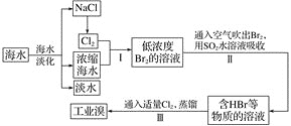
(1)步骤Ⅰ获得Br2的化学反应的离子方程式为_______。
(2)步骤Ⅱ用SO2水溶液吸收Br2,使溴蒸气转化为氢溴酸以达到富集的目的,其反应的化学方程式为____。在该反应中,氧化剂是____(填化学式);若反应中生成2mol HBr,则消耗___mol SO2。
(3)根据上述反应可判断出SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火箭燃料偏二甲肼(CH3)2N-NH2与NO2反应放出巨大的能量,能把500t以上的仪器设备送入太空,这是液体推进剂的优点。
(1)液态偏二甲肼(CH3)2N-NH2与氨气性质相似,易溶于水显弱碱性。易溶于水的原因是_______,写出溶于水后的电离方程式______________。
(2)氨-次氯酸钠法制取偏二甲肼(CH3)2N-NH2原理如下:
反应- NH3+NaClO→NaOH+Cl-NH2
反应二 Cl-NH2+HN(CH3)2→(CH3)2N-NH2+HCl
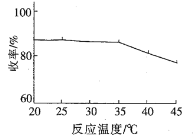
①模拟实验得到温度与收率如下关系图,温度约为_______℃时收率最高,约为________℃以后收率下降,收率下降的主要原因是温度升高,_________挥发所致。
②氯化铵是制取偏二甲肼(CH3)2N-NH2的缓冲剂,模拟实验得到加入氯化铵与收率的关系图如下:
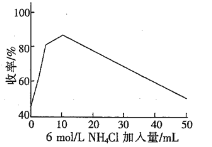
请结合原理知识解释收率升高的原因____________。
(3)固体推进剂如硼铝或纳米铝粉比液体推进剂灌装简单、无需临时加注,但与液体推进剂相比其最大缺点是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素X、Y、Z、W在周期表中的位置如图所示,其中Z元素的最外层电子数是内层电子总数的1/2。下列说法不正确的是

A.Z元素位于周期表的第3周期第VA族
B.X、W元素的最高价氧化物对应水化物的酸性:W强于X
C.Y元素的气态氢化物的热稳定性比Z的低
D.X与W可形成共价化合物XW2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的近似值为6.02×1023。按要求完成下列填空:
(1)1molCl2中约含有___个氯气分子,约含有__个氯原子。含有6.02×1023个氢原子的H2SO4的物质的量是___;
(2)某硫酸钠溶液中含有3.01×1023个Na+,则该溶液中SO42-的物质的量是___。
(3)2L1mol/LMgCl2中镁离子的物质的量为___,Cl-的物质的量浓度为___。
(4)三种盐的混合溶液中含有0.2molNa+、0.25molMg2+、0.4molCl-、SO42-,则SO42-的微粒个数约为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙、丙三个体积均为2L的恒容密闭容器,按不同投料比Z[![]() 进行反应: 4HCl(g)+O2(g)
进行反应: 4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) △H。在不同温度T条件下达到平衡时,HCl的平衡转化率与Z和T的关系如下表所示。
2Cl2(g)+2H2O(g) △H。在不同温度T条件下达到平衡时,HCl的平衡转化率与Z和T的关系如下表所示。
容器 | 起始时 | 平衡时HCl转化率 | |||
n(HCl)/mol | Z | T=100℃ | T=200℃ | T=300℃ | |
甲 | 0.8 | a | 96% | 94% | 90% |
乙 | 0.8 | b | 46% | 44% | 40% |
丙 | 0.8 | 4 | 95% | 88% | 80% |
下列说法正确的是
A.b<4
B.温度升高时,反应速率减慢,所以转化率下降
C.丙容器中,300℃平衡时,c(O2)=0.04molL-1
D.若甲容器温度在300时需要5min达到平衡,则此时间内v(Cl2)=0.036molL-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是NO2和O2形成的原电池装置。下列说法不正确的是
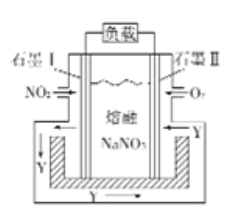
A. 石墨Ⅱ做正极,O2发生还原反应
B. 该电池放电时NO3-从右侧向左侧迁移
C. 当消耗1mol NO2时,电解质中转移1mol e
D. 石墨Ⅰ附近发生的反应为NO2+NO3--e-=N2O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨时,在某个密闭容器中发生反应:3H2(g)+N2(g)![]() 2NH3(g)
2NH3(g)
(1)下列能使反应速率加快的是_____________________
①升高温度 ②减小容器体积 ③通入N2 ④通入Ar使压强增大 ⑤通入HCl气体 ⑥加入合适的催化剂
A.①③④⑤ B.①②③⑥ C.①②③④ D.②④⑤⑥
(2)在恒温、恒容的条件下,下列说法能表示反应达到化学平衡状态的是__________
①当有1molN2被消耗,就有2molNH3生成
②当有6molH—H键形成时,就有12molN—H键形成
③2![]() 正(N2)=
正(N2)=![]() 逆(NH3)
逆(NH3)
④N2的物质的量不再变化
⑤H2、N2、NH3的浓度之比等于3:1:2
⑥混合气体的密度不变
⑦混合气体的压强不变
⑧混合气体的平均相对分子质量不变
A.①③④⑤⑦ B.①②③④⑧ C.②③④⑦⑧ D.②④⑤⑥
(3)在2 L定容密闭容器中通入1 mol N2(g)和3 mol H2(g),发生反应:3H2(g)+N2(g)![]() 2NH3(g)(放热反应)。测得压强-时间图像如图甲,测得p2=0.8p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如图乙图像。
2NH3(g)(放热反应)。测得压强-时间图像如图甲,测得p2=0.8p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如图乙图像。
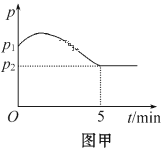
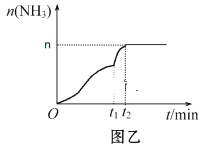
①如图甲,反应开始至平衡时NH3的平均反应速率为_____________________,平衡时氢气的转化率为_________。
②如图乙,下列说法正确的是_________
A.t1时刻可能是加入了催化剂
B.改变条件可以使H2 100℅转化为NH3
C.增大N2的浓度,可以提高H2的转化率
D.t2时刻,N2的浓度与NH3的浓度之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置的说法不正确的是
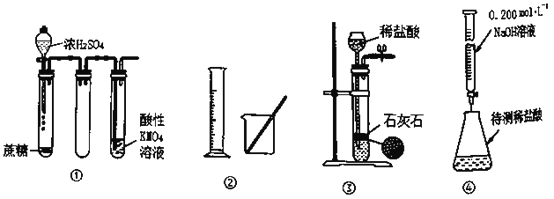
A.装置①中酸性高锰酸钾溶液中出现气泡,且颜色逐渐褪去
B.利用②中仪器可以配置75%的酒精溶液
C.装置③可用于实验室制备CO2气体
D.装置④可用来测定未知浓度的稀盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com