
���� ��1��ϡ����������������Һ��Ӧ�����Ȼ��ƺ�ˮ��
��2��̼������ϡ���ᷴӦ���������ƺͶ�����̼��ˮ��
��3��FeCl3 ��Һ��NaOH��Һ��Ӧ���������������Ȼ��ƣ�
��4��ϡH2SO4��Ba��OH��2��Һ��Ӧ�������ᱵ��ˮ��
��5������ϡ���ᷴӦ�����Ȼ�����������
��� �⣺��1��ϡ����������������Һ��Ӧ�����Ȼ��ƺ�ˮ�����ӷ���ʽ��H++OH-=H2O��
�ʴ�Ϊ��H++OH-=H2O��
��2��̼������ϡ���ᷴӦ���������ƺͶ�����̼��ˮ�����ӷ���ʽ��CO32-+2H+=CO2��+H2O��
�ʴ�Ϊ��CO32-+2H+=CO2��+H2O��
��3��FeCl3 ��Һ��NaOH��Һ��Ӧ���������������Ȼ��ƣ����ӷ���ʽ��Fe3++3OH-=Fe��OH��3����
�ʴ�Ϊ��Fe3++3OH-=Fe��OH��3����
��4��ϡH2SO4��Ba��OH��2��Һ��Ӧ�������ᱵ��ˮ�����ӷ���ʽ��2H++SO42-+Ba2++2OH-=BaSO4��+2H2O��
�ʴ�Ϊ��2H++SO42-+Ba2++2OH-=BaSO4��+2H2O��
��5������ϡ���ᷴӦ�����Ȼ��������������ӷ���ʽ��2Al+6H+=2Al3++3H2�����ʴ�Ϊ��2Al+6H+=2Al3++3H2����
���� ���⿼�������ӷ���ʽ����д����ȷ��Ӧʵ�ʼ����ӷ���ʽ��д�����ǽ���ؼ���ע�����ӷ�ӦӦ��ѭ����ʵ����ѭԭ�Ӹ�����������غ���ɣ���Ŀ�ѶȲ���


 ��ٽ������½������������ϵ�д�
��ٽ������½������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1.2 mol/L | B�� | 2.0mol/L | C�� | 0.18 mol/L | D�� | 0.24mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��֪H+��aq��+OH-��aq���TH2O��l����H=-57.3 kJ/mol����ϡH2SO4��ϡBa��OH��2��Һ��Ӧ����2 mol H2O�ķ�Ӧ�ȡ�H=-2��57.3 kJ/mol | |
| B�� | ��֪S��s��+$\frac{3}{2}$O2��g���TSO3��g����H=-395.7 kJ/mol������ǵ�ȼ����Ϊ395.7 kJ/mol | |
| C�� | ��֪C��ʯī��s���TC�����ʯ��s����H=+1.9 kJ/mol������ʯ��ʯī�ȶ� | |
| D�� | ��֪2H2��g��+O2��g���T2H2O��l����H=-571.6 kJ/mol����H2��ȼ����Ϊ285.8 kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ѧ��Ӧ���ʱ仯ʱ����ѧƽ��һ�������ƶ� | |
| B�� | ����Ӧ���еij̶ȴ�����Ӧ����һ���� | |
| C�� | ��ѧƽ�ⷢ���ƶ�ʱ����ѧ��Ӧ����һ���仯 | |
| D�� | ֻ�д��������£��Żᷢ����ѧ��Ӧ���ʱ仯������ѧƽ�ⲻ�ƶ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ԭ���� | B�� | ������ | C�� | ��� | D�� | ���ʵ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ˮ�������c��H+��•c��OH-��=10-20����Һ�У�Na+��Cl-��S2-��SO32- | |
| B�� | �μ���ɫ��̪����Ϊ��ɫ����Һ��Na+��CO32-��K+��ClO-��SO42- | |
| C�� | ���루NH4��2Fe��SO4��2•6H2O�������Һ�У�Na+��H+��Cl-��NO3- | |
| D�� | �����£�pH��7����Һ�У�I-��SO42-��Al3+��K+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | SiO2������HF��Ӧ��������NaOH��Ӧ���������������� | |
| B�� | ��觺ͺ챦ʯ����Ҫ�ɷֶ���SiO2��SiO2��Si��������뵼��IJ��� | |
| C�� | ������SiO2����Na2CO3��Ӧ�ų�CO2��˵��H2SiO3������ǿ��H2CO3 | |
| D�� | Na2SiO3��Һ�м���������Ʊ����ὺ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | 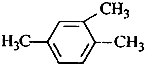 1��3��4-���ױ� 1��3��4-���ױ� | |
| B�� | 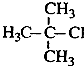 2-��-2-�ȱ��� 2-��-2-�ȱ��� | |
| C�� | 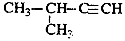 2-��-3-��Ȳ 2-��-3-��Ȳ | |
| D�� | CH3CH2C��CH3��2CH��C2H5��CH3 3��3��4-�������� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com