分析:(1)依据热化学方程式和盖斯定律计算分析得到所需热化学方程式;
(2)①平均反应速率=
计算得到;
②若想加快正反应速率的同时提高CO的转化率,依据化学反应影响因素和平衡移动原理分析选择的条件;
③结合平衡常数概念,依据化学平衡三段式列式计算得到;
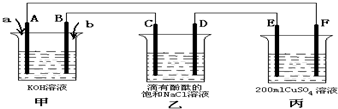
(3)甲为原电池,乙、丙为电解池,当向甲池通入气体a和b时,D极附近呈红色,说明D为电解池的阴极,C为电解池的阳极,b为正极,a为负极,E为阳极,F为阴极;
①a为甲醇电极商十点钟发生氧化反生成碳酸盐;
②乙中是电极饱和食盐水;
③依据电极反应和电子守恒计算所得溶液的PH.
解答:
解:(1)①CO
2(g)+3H
2(g)?CH
3OH(l)+H
2O (g)△H=Q
1kJ?mol
-1②CH
3OH(l)+
O
2(g)?CO
2(g)+2H
2(g)△H=Q
2kJ?mol
-1③H
2O(g)=H
2O(l)△H=Q
3kJ?mol
-1,依据盖斯定律①×2+②×3+③×2得到:
表示甲醇的燃烧热的热化学方程式为CH
3OH(l)+
O
2(g)═CO
2(g)+2H
2O(l)△H=(2Q
1+3Q
2+2Q
3) kJ?mol
-1;
故答案为:CH
3OH(l)+
O
2(g)═CO
2(g)+2H
2O(l)△H=(2Q
1+3Q
2+2Q
3) kJ?mol
-1;
(2)业上可用CO和H
2O(g)来合成CO
2 和H
2,再利用(1)中反应原理合成甲醇.某温度下,将1molCO和1.5molH
2O充入10L固定密闭容器中进行化学反应:CO(g)+H
2O(g)?CO
2(g)+H
2(g)△H>0,当反应进行到10min时达到平衡,此时测得H
2为0.6mol,依据化学平衡三段式列式
CO(g)+H
2O(g)?CO
2(g)+H
2(g)
起始量(mol) 1 1.5 0 0
变化量(mol) 0.6 0.6 0.6 0.6
平衡量(mol) 0.4 0.9 0.6 0.6
故答案为:6×10
-3 mol?L
-1?min
-1;
①0~10min内H
2O(g)的平均反应速率=
=0.006mol/L?min;
故答案为:0.006mol/L?min;
②CO(g)+H
2O(g)?CO
2(g)+H
2(g)△H>0,反应是气体体积不变的吸热反应,若想加快正反应速率的同时提高CO的转化率,可以采用的方法是;
a.升高温度,反应速率增大,平衡正向进行,故a符合;
b.缩小容器的体积,压强增大,平衡不变,速率增大,不能提高一氧化碳转化率,故B不符合;
c.增大H
2O (g)的浓度,反应速率增大,一氧化碳转化率增大,故c符合;
d.加入适当的催化剂,改变反应速率,不改变化学平衡,一氧化碳转化率不变,故d不符合;
故答案为:ac;
③计算平衡常数,K=
=1
若保持温度容积不变再向其中充入1molCO和0.5molH
2O(g),设生成氢气物质的量为x
CO(g)+H
2O(g)?CO
2(g)+H
2(g)
起始量(mol) 1+0.4 0.9+0.4 0.6 0.6
.6变化量(mol) x x x x
平衡量(mol) 1.4-x 1.4-x 0.6+x 0.6+x
=1
x=0.4mol
此时平衡混合气体中H
2的体积分数=
×100%=25%
故答案为:25%;
(3)甲为原电池,乙、丙为电解池,当向甲池通入气体a和b时,D极附近呈红色,说明D为电解池的阴极,C为电解池的阳极,b为正极,a为负极,E为阳极,F为阴极;
①上述分析可知a物质为甲醇,电极反应为:CH
3OH-6e
-+8OH
-=CO
32-+6H
2O;
故答案为:CH
3OH;CH
3OH-6e
-+8OH
-=CO
32-+6H
2O;
②乙中是电极饱和食盐水,生成氯气和氢气、氢氧化钠溶液,反应的化学方程式为:2NaCl+2H
2O
2NaOH+Cl
2↑+H
2↑;
故答案为:2NaCl+2H
2O
2NaOH+Cl
2↑+H
2↑;
③当乙装置中C电极收集到224mL(标况下)气体时,生成氯气物质的量=
=0.01mol,2Cl
--2e
-=Cl
2↑,电子转移0.02mol,丙中电解硫酸铜的反应为:2CuSO
4+2H
2O
2Cu+O
2↑+2H
2SO
4,电子转移4mol,反应2mol硫酸铜,生成硫酸2mol,电子转移0.02mol,生成硫酸0.01mol,氢离子浓度=0.02mol,c(H
+)=
=0.1mol/L,溶液的pH=1
故答案为:1;