
| A. | 48% | B. | 42% | C. | 26% | D. | 24% |
 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:解答题
 许多含碳、含氢物质是重要的化工原料.
许多含碳、含氢物质是重要的化工原料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2OH | B. | CH3COOC2H5 | C. | CH3OH | D. | CH3COOCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池的电解液为碱性溶液,负极为Fe | |
| B. | 电池放电时,负极反应为Fe+2OH--2e-═Fe(OH)2 | |
| C. | 电池充电过程中,阴极附近溶液的pH减小 | |
| D. | 电池充电时,OH-向阳极迁移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油产品--直馏汽油和裂化汽油的成分相同 | |
| B. | 获得上述化石能源的过程均为化学变化 | |
| C. | 水煤气是通过煤的液化得到的气体燃料 | |
| D. | 天然气是一种清洁能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 等质量的硫蒸气和硫固体分别完全燃烧,前者放出的热量少 | |
| B. | 如图可表示C和H2O(g)反应过程中的能量变化 | |
| C. | 吸热反应一定要加热,才能进行 | |
| D. | 已知中和热为57.3 kJ•mol-1,则浓硫酸与NaOH溶液反应生成 1mol H2O时,共放出57.3 kJ的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
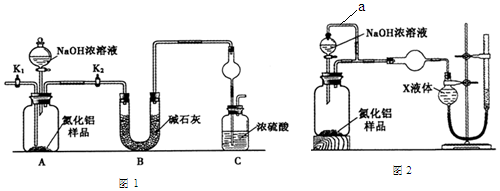
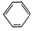
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com