
����Ŀ����﮵�ص����С�������������dz��õ�һ�ε�أ��õ�ط�Ӧԭ����ͼ��ʾ�����е����LiClO4���ڻ���л��ܼ��У�Li+ͨ�������Ǩ����MnO2�����У�����LiMnO2 �� �ش��������⣺ 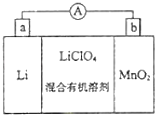
��1�����·�ĵ�������������������������ĸ����
��2�����������Ӧʽ ��
��3���Ƿ����ˮ�������еĻ���л��ܼ�������ǡ�����ԭ���� ��
��4��MnO2����KOH��KClO3�ڸ����·�Ӧ������K2MnO4 �� ��Ӧ�Ļ�ѧ����ʽΪ �� K2MnO4��������Һ���绯������KMnO4��MnO2�����ʵ���֮��Ϊ ��
���𰸡�
��1��b��a
��2��MnO2+e��+Li+=LiMnO2
��3���缫Li�ǻ��ý���������ˮ��Ӧ
��4��3MnO2+KClO3+6KOH ![]() 3K2MnO4+KCl+3H2O��2��1
3K2MnO4+KCl+3H2O��2��1
���������⣺��1��LiΪ������MnO2Ϊ������ԭ��ع���ʱ�����·�ĵ������������������������b������a�������Դ��ǣ�b��a����2��MnO2Ϊ����������ԭ���缫����ʽΪMnO2+e��+Li+=LiMnO2 �� ���Դ��ǣ�MnO2+e��+Li+=LiMnO2����3��������ΪLi������ˮ��Ӧ��������ˮ�������еĻ���л��ܼ������Դ��ǣ��缫Li�ǻ��ý���������ˮ��Ӧ����4��MnO2����KOH��KClO3�ڸ����·�Ӧ������K2MnO4 �� ��Ӧ�ķ���ʽΪ3MnO2+KClO3+6KOH ![]() 3K2MnO4+KCl+3H2O��K2MnO4��������Һ���绯������KMnO4��MnO2 �� ��Ӧ��MnԪ�ػ��ϼ۷ֱ���+6�����ߵ�7�ۡ����͵�+4�ۣ���������ԭ��Ӧ�������ͻ�ԭ��֮���ʧ������Ŀ��ȿ�֪������KMnO4��MnO2�����ʵ���֮��Ϊ2��1�����Դ��ǣ�3MnO2+KClO3+6KOH
3K2MnO4+KCl+3H2O��K2MnO4��������Һ���绯������KMnO4��MnO2 �� ��Ӧ��MnԪ�ػ��ϼ۷ֱ���+6�����ߵ�7�ۡ����͵�+4�ۣ���������ԭ��Ӧ�������ͻ�ԭ��֮���ʧ������Ŀ��ȿ�֪������KMnO4��MnO2�����ʵ���֮��Ϊ2��1�����Դ��ǣ�3MnO2+KClO3+6KOH ![]() 3K2MnO4+KCl+3H2O��2��1��
3K2MnO4+KCl+3H2O��2��1��


 ȫ�ŵ�����Ԫ�ƻ�ϵ�д�
ȫ�ŵ�����Ԫ�ƻ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�����ڻ�ѧ��ռ����Ҫ��λ����ش��������⣺
��1������mgij���壬����˫ԭ�ӷ��ӹ��ɣ���Ħ������ΪM gmol��1 �� �������ӵ�������NA��ʾ����
�ٸ���������ԭ������Ϊ�� ���������ú���NA��ʽ�ӱ�ʾ��
�ڸ���������ˮ����������ˮ��Ӧ�����γ�V L��Һ������Һ�����ʵ���Ũ��Ϊ
��2����һ�����¶Ⱥ�ѹǿ�£�1�������X2��3�������Y2��������2����������û�����Ļ�ѧʽ��
��3��ij�λ����Һ�к���Na+��Mg2+��Cl����SO42�� �� ���Na+��Mg2+��Cl�������ʵ���Ũ������Ϊ��0.2mol
L��1��0.25molL��1��0.4molL��1 �� ��c��SO42����=��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����CO2��H2��CO��ɵĻ��������ͬ��ͬѹ���뵪�����ܶ���ͬ����û��������CO2��H2��CO�������Ϊ( )
A. 29��8��3 B. 22��1��14 C. 13��8��29 D. 26��16��57
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�ܱյ�2L������װ��4mol SO2��2mol O2 �� ��һ�������¿�ʼ��Ӧ2SO2��g��+O2��g��2SO3��g����2minĩ�����������1.6mol SO2 �� ����㣺
��1��2minĩSO3��Ũ�ȣ�
��2��2min��SO2��ƽ����Ӧ���ʣ�
��3��2minĩSO2��ת���ʣ�
��4����Ӧǰ���ѹǿ֮�ȣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��±��Ԫ�صĵ��ʺͻ�����ܶ࣬���ǿ���������ѧ���ʽṹ�����ʵ����֪ʶȥ��ʶ���������ǣ�
��1���ڲ�̫ϡ����Һ�У���������Զ����ӵϣ�HF��2��ʽ���ڵģ�ʹ�������ӵϵ��������� ��
��2��������±��ṩ�ĵ�һ�����������жϣ����п������ɽ��ȶ��ĵ��������ӵ�±��ԭ���� ��
�� | �� | �� | �� | |
��һ�����ܣ�kJ/mol�� | 1681 | 1251 | 1140 | 1008 |
��3����֪�ߵ�����������ʽ����ѧʽ�ֱ�ΪH5IO6���ṹ����ͼ����HIO4 �� ǰ��Ϊ��Ԫ�ᣬ����ΪһԪ�ᣮ��Ƚ϶�������ǿ����H5IO6HIO4 �� �����������������=����
��4������ˮ�е��ܽ����ȻС�����ڵ⻯����Һ���ܽ��ȴ������������������Һ�з������з�ӦI��+I2=I3�� �� I3�����ӵ�����ԭ����Χ�Ҽ����ӶԶ���Ϊ �� ��KI3���Ƶģ�����CsICl2�ȣ���֪CsICl2���ȶ��������ֽ⣬���������ɾ����ܸ�������ʣ�����������ʽ������
A��CsICl2=CsCl+ICl B��CsICl2=CsI+Cl2
��5����֪CaF2������ܶ�Ϊ��g/cm3 �� NAΪ�����ӵ�������CaF2�����ı߳�Ϊa pm����CaF2����Է����������Ա�ʾΪ���ú�a��ʽ�ӱ�ʾ���� 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����Fe��Fe2O3�Ļ�������300mL 2mol/L��������Һ�У���Ӧ��ȫ������ʣ�࣬����4.48L NO���壨��״����������Ӧ�����Һ�м���1mol/L��NaOH��Һ��Ҫʹ��Ԫ��ȫ����������������NaOH��Һ����������ǣ� ��
A.400mL
B.500mL
C.450mL
D.��ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A3+��������46�����ӣ�������Ϊ115����Aԭ�Ӻ�����������ǣ� ��
A. 46B. 66C. 115D. 49
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д�ɻ�ѧ����ʽ��ȷ���ǣ� ��
A.Zn2++2OH���TZn��OH��2��? ZnCO3+2NaOH�TZn��OH��2��+Na2CO3
B.Ba2++SO ![]() �TBaSO4��????? Ba��OH��2+H2SO4�TBaSO4��+2H2O
�TBaSO4��????? Ba��OH��2+H2SO4�TBaSO4��+2H2O
C.Ag++Cl���TAgCl��????? AgNO3+KCl�TAgCl��+KNO3
D.Cu+2Ag+�TCu2++2Ag???? Cu+2AgCl�TCuCl2+2Ag
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ؽ������Ӿ��ж��ԣ�ʵ�������мס��������ؽ������ӵķ�Һ����Һ������ʼ��ԣ���Ҫ�ж�����ΪBa2+ �� �罫�ס�������Һ��һ��������ϣ��������Խ��ͣ����ҷ�Һ�п��ܺ��е������ǣ� ��
A.Cu2+��SO ![]() ?
?
B.Cu2+��Cl��
C.K+��SO ![]()
D.Ag+��NO ![]()
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com