
����Ŀ�����ǻ�����������1-100nm,1nm=10-9m���������������������IJ��Ϻ�������ʹ��ѧ�ڲ��ϡ���Դ��������������ѧ������Խ��Խ��Ҫ�����á��������������ܽ���Һ���ܼ����γ�һ�ַ�ɢϵ���Ը÷�ɢϵ����ɢ�ʿ�������������ȷ������ ��
A. �÷�ɢϵ�ܷ��������ЧӦ B. �÷�ɢϵΪ��Һ
C. �÷�ɢϵ��������Һ D. �÷�ɢϵ����һ��ʱ����ܺܿ���ֲַ�����

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ش��������⣺
��1������ȥ�������������������̼�ظ֣�������Ũ�����У�10���Ӻ���������ͭ��Һ�У�Ƭ�̺�ȡ���۲죬�������������Ա仯����ԭ���� ��
��2������ȡ��ȥ�������������������̼�ظ֣�6.0g����15.0mLŨ�����У����ȣ���ַ�Ӧ��õ���ҺX���ռ�������Y��
�ټ�ͬѧ��ΪX�г�Fe3+����ܺ���Fe2+ �� д������Fe2+���п��ܵ����ӷ���ʽ�� �� ��д��һ�����ɣ�
����ͬѧȡ336mL����״��������Yͨ��������ˮ�У�������Ӧ�Ļ�ѧ����ʽΪ�� ��
Ȼ���������BaCl2��Һ�����ʵ�������ø������2.33g�����ڴ���֪����Y��SO2���������Ϊ ��
��3����100mLˮ��Ͷ��Na��Al��16�ˣ���ַ�Ӧ��ʣ�����1g������ų�H2�����Ϊ������״���£�
��4����һ������Fe��Fe2O3��CuO�����Ͷ��100mL 2.2mol/L��������Һ�У���ַ�Ӧ������896mL��״���µ����壬�ò�����1.28g�����˺�����Һ�м���2mol/L��NaOH��Һ������40mLʱ��ʼ���ֳ���������Һ��FeSO4�����ʵ���Ũ��Ϊ������Һ���Ϊ100mL��mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£��ü�����������������NOx������Ⱦ����֪��
��CH4��g��+4NO2��g��=4NO��g��+CO2 ��g��+2H2O��g����H1=��574kJmol��1
��CH4��g��+4NO��g��=2N2��g��+CO2��g��+2H2O��g����H2=��1160kJmol��1
����ѡ����ȷ���ǣ� ��
A.CH4��g��+2NO2��g��=N2��g��+CO2��g��+2H2O��g����H=��867kJmol��1
B.CH4��g��+4NO2��g��=4NO��g��+CO2��g��+2H2O��l���ķ�Ӧ��Ϊ��H3 �� ���H3����H1
C.����0.2molCH4��ԭNO2��N2 �� ��Ӧ�зų�������һ��Ϊ173.4kJ
D.���ñ�״����2.24LCH4��ԭNO2��N2 �� ����������ת�Ƶĵ���Ϊ1.6mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б�����ȷ����
A.�ø�����Ƶ�ԭ����ͨ�����������е��Ҵ��������
B.��������AB2������״̬���ܵ��磬˵��AB2�ǵ����
C.�ƹ�ʹ��úҺ���������Լ����������������̼���ŷ�
D.������������ࡢ��֬�������ʾ������Ⱦ���ˮ����ܱ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij100mL��Һ���ܺ���Na+��NH4+��Fe3+��CO32����SO42����Cl���е������֣�ȡ����Һ��������ʵ�飬ʵ�������ͼ���������Լ�������������ȫ���ݳ�������˵������ȷ���ǣ�������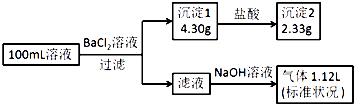
A.ԭ��Һһ������CO32����SO42�� �� һ��������Fe3+
B.ԭ��Һһ������Cl�� �� ���ܴ���Na+
C.ԭ��Һ��c��Cl������0.1molL��1
D.��ԭ��Һ�в�����Na+ �� ��c��Cl������0.1molL��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����Ȼ�ѧ����ʽ��
��CaCO3��s���TCaO+CO2��g����H=+177.7kJ
��C��s��+H2O��s���TCO��g��+H2��g����H=��131.3kJmol��1
�� ![]() H2SO4��1��+NaOH��1���T
H2SO4��1��+NaOH��1���T ![]() Na2SO4��1��+H2O��1����H=��57.3kJmol��1
Na2SO4��1��+H2O��1����H=��57.3kJmol��1
��C��s��+O2��g���TCO2��g����H=��393.5kJmol��1
��CO��g��+ ![]() O2��g���TCO2��g����H=��283kJmol��1
O2��g���TCO2��g����H=��283kJmol��1
��HNO3��aq��+NaOH��aq���TNaNO3��aq��+H2O��1����H=��57.3kJmol��1
��2H2��g��+O2��g���T2H2O��1����H=��517.6kJmol��1
��1�������Ȼ�ѧ����ʽ�У�����ȷ���� �� ����ȷ�����ɷֱ��� ��
��2������������Ϣ��д��Cת��ΪCO���Ȼ�ѧ����ʽ�� ��
��3��������Ӧ�У���ʾȼ���ȵ��Ȼ�ѧ����ʽ������ʾ�к��ȵ��Ȼ�ѧ����ʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С����ij2L�ܱ������м���һ�����Ĺ���A������B��������ӦA��s��+2B��g��D��g��+E��g����H=QkJmol��1 �� ��T1��ʱ����Ӧ���е���ͬʱ���ø����ʵ����ʵ������±���
ʱ�䣨min�� | 0 | 10 | 20 | 30 | 40 | 50 |
B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
��1��T1��ʱ���÷�Ӧ��ƽ�ⳣ��K=��
��2��30min��ֻ�ı�ijһ��������Ӧ���´ﵽƽ�⣬���ݱ��е������жϸı������������������ĸ��ţ���
a��ͨ��һ������B
b������һ�����Ĺ���A
c���ʵ���С���������
d�����߷�Ӧ��ϵ�¶�
e��ͬʱ����0.2molB��0.1molD,0.1molE
��3�����ڸ÷�Ӧ���ø����ʱ�ʾ�ķ�Ӧ������ʱ��Ĺ�ϵʾ������Ϊ��ͼ�е�������ţ� 
��4��ά��������������¶�T1���䣬����������м���1.60molB,0.20molD,0.20molE��nmolA���ﵽƽ����������20����ʱ�����ʵ�Ũ����ȫ��ͬʱ����Ͷ�����A�����ʵ���nȡֵ��Χmol��
��5��ά��������������¶�T1���䣬�����ʵ���ʼ���ʵ���Ϊ��n��A��=1.0mol��n��B��=3.0mol��n��D��=amol��n��E��=0mol���ﵽƽ���n��E��=0.50mol����a= ��
��6�������ܱ��������ȣ�ʵ����B��ת����B%��ʱ��仯��ʾ��ͼ��ͼ��ʾ��ͼ��֪��Q0������ڡ���С�ڡ�����c��v��v�棨����ڡ�����С�ڡ����ڡ����� 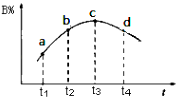
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ��ͨ������CO��g����H2��g�����ϳɼ״�CH3OH��g����
��1����һ���¶Ⱥ�ѹǿ�£�CO��g��+2H2��g��CH3OH��g����H=��128.8kJ/mol������10a mol CO��20a mol H2����2L���ܱ������У���ַ�Ӧ����CO��ת����Ϊ60%����÷�Ӧ��ƽ�ⳣ��Ϊ���ú�a�Ĵ���ʽ��ʾ����
����ʱ�����������Ͷ��10a mol CO,20a mol H2��10a mol CH3OH��g�����ж�ƽ���ƶ��ķ�������������ƶ������������ƶ������ƶ�������
��ԭƽ����ȣ�CO�����ʵ���Ũ��������������䡱��С������
��2���жϸ÷�Ӧ�ﵽƽ��״̬��������������ĸ��ţ���
A.���������ܶȲ���
B.��������ƽ����Է�����������
C.2v����H2��=v����CO��
D.������CO,H2��CH3OH��Ũ��֮��Ϊ1��2��1
E.CH3OH,CO,H2��Ũ�ȶ����ٷ����仯
��3��һ�������£����ݻ���ͬ�������ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ���й����������
���� | �� | �� | �� | |
��Ӧ��Ͷ���� | 1 mol CO�� | 1 mol CH3OH | 2 mol CH3OH | |
ƽ�� | ��Ӧ�����仯�ľ���ֵ��kJ�� | a | b | c |
��Ӧ��ת���� | ��1 | ��2 | ��3 | |
��a+b=��a1+a3�����������������=��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������
��1��ij�¶��£���ˮ�е�c��H+��=2.0��10��7mol/L����ʱ��Һ��c��OH����=mol/L�����¶Ȳ��䣬����ϡ����ʹc��H+��=5.0��10��4mol/L������Һ�У���ˮ���������c��H+��=mol/L����ʱ�¶�25�棨����ڡ��������ڡ����ڡ�����
��2��ij�¶��µ�ˮ��Һ�У�C ��H+��=10x mol/L��C ��OH����=10y mol/L��x��y�Ĺ�ϵ��ͼ��ʾ�����㣺���¶���ˮ�����ӻ�Ϊ �� 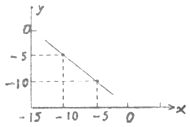
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com