
【题目】某工厂的工业废水中含有大量的FeSO4和CuSO4,为了减少污染并变废为宝,工厂拟定用以下流程从该废水中回收FeSO4和金属Cu。请根据以下流程图,回答相关问题:
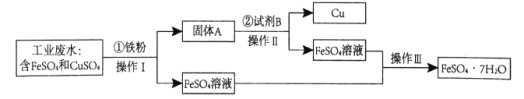
(1)操作Ⅰ和操作Ⅱ分离固体和溶液的方法是_____________。
(2)为了将CuSO4完全转化,步骤①加入的铁粉应_______(选填“过量”或“少量”),其对应的化学方程式为___________。
(3)固体A的成分是铁和__________(填名称)。
(4)步骤②加入试剂B的稀溶液,B的化学式为_________ ,该物质在该反应中作_______剂(选填“氧化”或“还原”)。
(5)取1~2mlFeSO4溶液于试管中,滴加几滴NaOH溶液,生成的白色沉淀迅速变为灰绿色,最后变成_______________色。
(6)另取1~2ml FeSO4溶液于试管中,滴加几滴氯水,该反应的离子方程式为_______,向反应后的溶液中再滴加几滴__________溶液,溶液变为血红色。
【答案】过滤 过量 ![]() 铜单质 H2SO4 氧化 红褐色
铜单质 H2SO4 氧化 红褐色 ![]() KSCN
KSCN
【解析】
(1)分离固体和溶液的操作即过滤;
(2)为了保证CuSO4反应彻底,就需要加入过量的Fe粉;Fe与CuSO4溶液发生置换反应,方程式为:![]() ;
;
(3)固体A中除了未反应完的Fe,还有就是加入铁粉后置换出的Cu单质;
(4)分析步骤②可知,加入试剂B后Fe单质变成了FeSO4,而Cu单质不反应,所以B为稀硫酸;反应过程中,稀硫酸起氧化剂作用将Fe氧化;
(5)Fe2+与OH-反应生成白色的不稳定的Fe(OH)2,Fe(OH)2可以迅速被氧化发生反应:![]() ;最终生成红褐色的Fe(OH)3;
;最终生成红褐色的Fe(OH)3;
(6)FeSO4中加入氯水后发生氧化还原反应,离子方程式为:![]() ;由于反应后的溶液中有Fe3+,所以加入
;由于反应后的溶液中有Fe3+,所以加入![]() 后,溶液会出现血红色;
后,溶液会出现血红色;


科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(![]() )是最简单的一种。下列关于该化合物的说法错误的是
)是最简单的一种。下列关于该化合物的说法错误的是
A. 与环戊烯互为同分异构体
B. 二氯代物超过两种
C. 所有碳原子均处同一平面
D. 生成1 molC5H12至少需要2 molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种兴奋剂的结构简式如图所示,下列有关该物质的说法正确的是( )
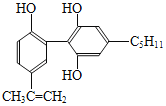
A.该分子中的所有原子有可能共平面
B.该物质与苯酚属于同系物,遇FeCl3溶液显紫色
C.滴入KMnO4(H+)溶液,观察紫色褪去,说明结构中一定存在不饱和碳碳键
D.1mol该物质分别与浓溴水、H2反应时最多消耗的Br2和H2分别为4mol、7mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种苯的同系物0.1mol 在足量的氧气中完全燃烧,将产生的高温气体依次通过浓硫酸和氢氧化钠溶液,使浓硫酸增重9g,氢氧化钠溶液增重35.2g。实践中可根据核磁共振氢谱(PMR)上观察到氢原子给出的峰值情况,确定有机物的结构。此含有苯环的有机物,在PMR谱上峰给出的稳定强度仅有四种,它们分别为:①3∶1∶1②1∶1∶2∶6③3∶2④3∶2∶2∶2∶1,请分别推断出其对应的结构:①_______;②_________________;③___________;④___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,W的原子序数是Z的原子序数的一半,W、X、Y三种元素形成的化合物M结构如图所示。下列叙述正确的是
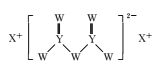
A.原子半径:Z>Y>W
B.化合物M中W的原子满足8电子稳定结构
C.对应单质的熔点:X>Z>Y
D.Z的氧化物对应的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期元素X、Y、Z、W、T的原子序数依次增大,Y、Z、W位于同一周期,X的最简单氢化物分子的空间结构为正四面体,Y在同周期中电负性最小,二元化合物E中元素Y和W的质量比为23:16;同周期元素简单离子中,元素Z形成的离子半径最小;T元素的价电子排布式为3d104s1。下列说法正确的是( )
A.简单离子的半径Y>Z>W
B.最高价氧化物对应水化物的酸性W>Z>X
C.W和T的单质混合加热可得化合物T2W
D.W的单质在足量的氧气中燃烧,所得产物溶于水可得强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知P4单质的结构如下,P4在 KOH 溶液中的变化是:P4 + 3KOH + 3H2O = 3KH2PO2 + PH3 ↑,下列说法正确的是( )
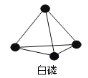
A.产物 PH3分子中所有的原子可能共平面
B.31gP4含有 1.5NA个 P P 键
C.相关元素的电负性大小顺序:P > O > H > K
D.P4中 P 原子为 sp2杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() 可以写成
可以写成![]() 。有机物A的结构如下图所示,请回答:
。有机物A的结构如下图所示,请回答:

(1)有机物A分子所含官能团的名称为__________________。
(2)1mol A最多与____mol H2在一定条件下反应可生成环烃B。
(3)有机物A的分子式为_____________________________。
(4)有机物C是A的同分异构体,属于芳香烃,且C在一定条件下可发生聚合反应,生成高分子化合物D。则C的结构简式为______________,D的结构简式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蕴藏在海底的大量“可燃冰”,其开发利用是当前解决能源危机的重要课题。用甲烷制水煤气(CO、H2),再合成甲醇可以代替日益供应紧张的燃油。下面是产生水煤气的几种方法:
①CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1=+206.2kJ·mol-1
②CH4(g)+![]() O2(g)=CO(g)+2H2(g) ΔH2=-35.4kJ·mol-1
O2(g)=CO(g)+2H2(g) ΔH2=-35.4kJ·mol-1
③CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH3=+165.0kJ·mol-1
(1)CH4(g)与CO2(g)反应生成CO(g)和H2(g)的热化学方程式为__。
(2)从原料、能源利用的角度,分析以上三个反应,作为合成甲醇更适宜的是反应__(填序号)。
(3)也可将CH4设计成燃料电池,来解决能源问题,如图装置所示。持续通入甲烷,在标准状况下,消耗甲烷VL。
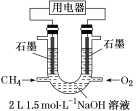
①0<V≤33.6L时,负极电极反应式为__。
②33.6L<V≤67.2L时,电池总反应方程式为__。
③V=44.8L时,溶液中离子浓度大小关系为__。
(4)工业合成氨时,合成塔中每产生1molNH3,放出46.1kJ的热量。某小组研究在上述温度下该反应过程中的能量变化。他们分别在体积均为VL的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下表:
容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达到平衡时体系能量的变化/kJ | ||
N2 | H2 | NH3 | |||
Ⅰ | 1 | 4 | 0 | t1 | 放出热量:36.88 |
Ⅱ | 2 | 8 | 0 | t2 | 放出热量:Q |
①容器Ⅰ中,0~t1时间的平均反应速率v(H2)=__。
②下列叙述正确的是__(填字母)。
a.平衡时,两容器中H2的体积分数相等
b.容器Ⅱ中反应达到平衡状态时,Q>73.76
c.反应开始时,两容器中反应的化学反应速率相等
d.平衡时,容器中N2的转化率:Ⅰ<Ⅱ
e.两容器达到平衡时所用时间:t1>t2
(5)如图是在反应器中将N2和H2按物质的量之比为1∶3充入后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的体积分数随压强的变化曲线。

①曲线a对应的温度是__。
②图中M、N、Q点平衡常数K的大小关系是__。
③M点对应的H2转化率是__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com