
���� A��ijԪ�ص�һ�ֵ��ʣ�������������ȫȼ�յõ�һ����ɫ���壬��������ʹ����ʯ��ˮ����ǣ���������Ϊ�����ܶȵ�1.375������״���������壬����������Է�������=32��1.375=44��Ӧ��CO2������AΪ̼��B����������������������Һ������������Һ�м����������ʱ��������ɫ��״�������˳��������Ϊ������ˮ�İ�ɫ��ĩ������һ�ֱ�̼�����Ի������ᣬ�����ӦΪ���ᣬ��B��ʯ��ʯ�����������ϼ��ȵõ�C��C�ڸ���ʱ�������̶��۵㣬�÷�ӦΪ��ҵ����ͨ�����ķ�Ӧ������BΪSiO2��CΪ��ͨ�������ݴ˴��⣮
��� �⣺A��ijԪ�ص�һ�ֵ��ʣ�������������ȫȼ�յõ�һ����ɫ���壬��������ʹ����ʯ��ˮ����ǣ���������Ϊ�����ܶȵ�1.375������״���������壬����������Է�������=32��1.375=44��Ӧ��CO2������AΪ̼��ȼ�շ�ӦΪC+O2$\frac{\underline{\;��ȼ\;}}{\;}$CO2��B����������������������Һ������������Һ�м����������ʱ��������ɫ��״�������˳��������Ϊ������ˮ�İ�ɫ��ĩ������һ�ֱ�̼�����Ի������ᣬ�����ӦΪ���ᣬ�����еķ�ӦΪSiO2+2NaOH=Na2SiO3+H2O��Na2SiO3+2HCl=2NaCl+H2SiO3������B��ʯ��ʯ�����������ϼ��ȵõ�C��C�ڸ���ʱ�������̶��۵㣬�÷�ӦΪ��ҵ����ͨ�����ķ�Ӧ������BΪSiO2��CΪ��ͨ�����������е��йط�Ӧ�Ļ�ѧ����ʽΪNa2CO3+SiO2=Na2SiO3+CO2����CaCO3+SiO2=CaSiO3+CO2����
�ʴ�Ϊ��̼��SiO2����ͨ������C+O2$\frac{\underline{\;��ȼ\;}}{\;}$CO2��SiO2+2NaOH=Na2SiO3+H2O��Na2SiO3+2HCl=2NaCl+H2SiO3����Na2CO3+SiO2=Na2SiO3+CO2����CaCO3+SiO2=CaSiO3+CO2����
���� ���⿼�������ƶϣ���Ŀ�Ѷ��еȣ���Ҫѧ������ע��Ԫ�ػ��������ʣ�ע��������ѧ�����Ļ�ѧ��ҵ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������������Ԫ�����ȵĵ�һ��������� | |
| B�� | �ĵ縺�Ա���ĵ縺�Դ� | |
| C�� | ��Ȼ������Ԫ���У����ĵ�һ���������蘆ĵ�һ��������С | |
| D�� | ����������Ԫ����ĵ�һ�����ܱ�Ԫ�����ĵ�һ������С |
�鿴�𰸺ͽ���>>
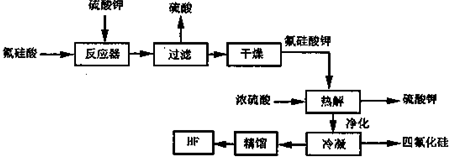
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʱ�䣨s�� ���ʵ�����mol�� ���� | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| SO2 | 1 | 0.7 | 0.5 | 0.35 | 0.2 | 0.01 | 0.1 | 0.1 |
| O2 | 0.5 | 0.35 | 0.25 | 0.18 | 0.1 | 0.05 | 0.05 | 0.05 |
| SO3 | 0 | 0.3 | 0.5 | 0.65 | 0.8 | 0.9 | 0.9 | 0.9 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 �йظ����ʵ��ƶ���ȷ���ǣ�������
�йظ����ʵ��ƶ���ȷ���ǣ�������| A�� | �����п��ܺ����ǻ� | B�� | �����п��ܺ������� | ||
| C�� | �����п��ܺ���ȩ�� | D�� | �����ʵķ���ʽ����ΪC3H4O3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��߷�Ӧ��������� | B�� | �ı�ƽ���������� | ||
| C�� | ��ͬ���̶ȸı����淴Ӧ������ | D�� | ��������Ӧ���ʣ���С�淴Ӧ���� |
�鿴�𰸺ͽ���>>
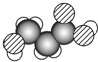
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
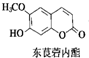 �в�ҩ�г����ڶ�ݹ�������������㶹��������ݹ�������ṹ��ͼ��ʾ�����ж�ݹ��������˵����ȷ���ǣ�������
�в�ҩ�г����ڶ�ݹ�������������㶹��������ݹ�������ṹ��ͼ��ʾ�����ж�ݹ��������˵����ȷ���ǣ�������| A�� | ����ʽΪC10H12O4 | |
| B�� | ����FeCl3��Һ������ɫ��Ӧ | |
| C�� | һ�������£�1 mol������������3 mol Br2��Ӧ | |
| D�� | һ�������£�1 mol������������1 mol NaOH��Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ͨ��״�����ǹ��� | B�� | ������-3��+3��+5�ȶ��ֻ��ϼ� | ||
| C�� | As2O5��Ӧˮ��������Ա�H3PO4�� | D�� | ��Ļ�ԭ�Ա����� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com