
分析 (1)要判断哪一种解释正确,可加入一种含有CH3COO-但溶液不显碱性的盐;
(2)如乙正确,从电离平衡移动的角度分析;
(3)CH3COONa溶液中醋酸根离子水解显碱性,醋酸根离子浓度减小.
解答 解:(1)CH3COONH4溶液中,CH3COO-和NH4+都发生水解,且水解程度相等,CH3COONH4溶液呈中性,将CH3COONH4加入到0.1 mol•L-1醋酸中使pH增大,说明CH3COO-抑制了醋酸的电离,其它物质的水溶液都呈碱性,不能用于证明,
故答案为:B;
(2)如乙正确,醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,则溶液pH增大,
故答案为:乙;增大;
(3)CH3COONa溶液中醋酸根离子水解显碱性,醋酸根离子浓度减小,所以溶液中离子浓度大小关系:c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
故答案为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+).
点评 本题考查弱电解质的电离和盐类水解原理,题目难度不大,注意把握影响电离平衡和水解平衡的因素,侧重于考查学生对基础知识的应用能力.


科目:高中化学 来源: 题型:选择题
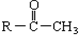 与NaOH溶液、碘水三者混和后可发生如下反应:
与NaOH溶液、碘水三者混和后可发生如下反应: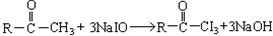
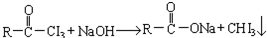
| A. | CH3CHO | B. | CH3CH2CHO | ||
| C. | CH3CH2COCH2CH3 | D. | CH3CH2COCH2 CH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 920kJ | B. | 496kJ | C. | 436kJ | D. | 188kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 若R为甲基则该物质的分子式可以表示为C16H10O7 | |
| B. | 分子中有三个苯环 | |
| C. | 1mol该化合物与NaOH溶液作用消耗NaOH的物质的量以及与H2加成所需的H2的物质的量分别是4 mol、8 mol | |
| D. | 1mol该化合物最多消耗溴水中Br2的物质的量为5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作 | 现象 | 结论 | |
| A | 向试管中的无色溶液内滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口 | 试纸不变蓝 | 不能确定原溶液中是否含有NH4+ |
| B | 加热盛有铜与浓硫酸的试管,发现试管底部出现白色固体,直接向试管中加入适量水 | 白色固体溶解,溶液变蓝色 | 白色固体为无水硫酸铜 |
| C | 将稀硫酸酸化的H2O2溶液滴入FeCl2溶液中 | 溶液变黄色 | 氧化性:H2O2>Fe3+ |
| D | 向蔗糖中加入浓硫酸,并不断用玻璃棒搅拌 | 变黑,体积膨胀,放出刺激性气体 | 浓硫酸具有脱水性和强氧化性,反应中生成C、SO2和CO2等 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ①②④⑤ | C. | ②③⑥ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的沸点:M>Q | |
| B. | Q元素的阴离子和V元素的阴离子都只有还原性 | |
| C. | M、Q、R、V四种元素组成的化合物的水溶液可以是碱性、中性和酸性 | |
| D. | Q与R可以组成2种离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,100g98%硫酸溶液中含有的氧原子数为4NA | |
| B. | 标准状况下,当活泼金属转移2NA个电子时,可与盐酸反应产生44.8LH2 | |
| C. | 标准状况下,2.24L CO和CO2混合气体中含有的碳原子数目为0.1NA | |
| D. | 常温常压下,0.1mol Cl2溶于水,转移的电子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com