
【题目】利用如图装置,完成很多电化学实验.下列有关此装置的叙述中,正确的是( ) 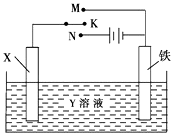
A.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阴极保护法
B.若X为碳棒,Y为NaCl溶液,开关K置于N处,可加快铁的腐蚀
C.若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动
D.若X为铜棒,Y为硫酸铜溶液,开关K置于N处,可用于铁表面镀铜,溶液中铜离子浓度将减小
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变为H2、CO。其过程如下: ![]() ,
, ![]()
下列说法不正确的是 ( )
A. 该过程中CeO2没有消耗
B. 该过程实现了太阳能向化学能的转化
C. 图中ΔH1=ΔH2+ΔH3
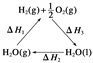
D. 以CO和O2构成的碱性燃料电池的负极反应式为:CO+4OH--2e-===CO![]() +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第ⅡA族相邻周期的A、B两种元素所在周期分别最多可排m和n种元素,且B在A的上周期,当A的原子序数为x时,B的原子序数可能为
A. x+mB. x-mC. x+nD. x-n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V1mL 1.0 mol/L HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。下列叙述正确的是

A. 做该实验时环境温度为22 ℃
B. 该实验表明化学能可以转化为热能
C. NaOH溶液的浓度约是1.00 mol/L
D. 该实验表明有水生成的反应都是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各溶液中,Na+浓度最大的是( )
A. 4L 0.5 mol/LNaCl溶液 B. 1L 0.3 mol/LNa2SO4溶液
C. 0.8L 0.4 mol/LNaOH溶液 D. 2L 0.15 mol/LNa3PO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【广东省汕头市潮阳实验学校2017届高三第三次模拟考试理综化学试题】利用铅蓄电池对下图装置进行供电,能模拟植物光合作用,将简单无机物转化为O2和C3H8O,下列说法不正确的是

A. 该装置实现了将太阳能、电能转化为化学能
B. b极上每生成0.1molO2,铅蓄电池的负极增重19.2g
C. a极上每生成0.1molC3H8O,有1.8mol电子发生转移
D. 质子交换膜的作用是传导电子、平衡电荷,沟通回路
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完全燃烧2mol某有机物,可以收集到标准状况下89.6L的CO2和6mol的H2O,同时消耗6molO2 , 试推断该有机物的分子式是( )
A.C2H4
B.C2H4O
C.C2H6
D.C2H6O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.SO2(g)+H2 O(g)=H2SO3(l),该过程熵值增大
B.SO2(g)= S(s)+O2(g); △H>0, △S<0,该反应能自发进行
C.3S(s)+2H2O(1)= SO2(g)+2H2S(g),室温下能自发进行
D.若某反应的△H<0,△S>0,则该反应一定能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016年普通高等学校招生全国统一考试(新课标Ⅱ卷)】酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)
温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
回答下列问题:
(1)该电池的正极反应式为 ,电池反应的离子方程式为 。
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn g。(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过____分离回收;滤渣的主要成分是MnO2、______和 ,欲从中得到较纯的MnO2,最简便的方法是 ,其原理是 。
(4)用废电池的锌皮制备ZnSO4·7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,铁变为_____,加碱调节至pH为 时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为_____时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。若上述过程不加H2O2后果是 ,原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com