
| A. | CH3COOC3H7 | B. | CH3COOC2H5 | C. | CH3COONa | D. | CH3CH2Br |
分析 中性有机物在酸性条件下可以水解生成相对分子质量相同的A和B,A是中性物质,B可以与碳酸钠反应放出气体,则A应为醇,B为酸,二者发生酯化反应生成酯类物质,且A、B的相对分子质量相等,以此解答该题.
解答 解:A.CH3COOC3H7水解生成CH3COOH、C3H7OH,二者相对分子质量相等,故A正确;
B.水解生成乙酸和乙醇,二者分子质量不同,故B错误;
C.CH3COONa水解生成醋酸和氢氧化钠,氢氧化钠为碱性,故C错误;
D.CH3CH2Br水解生成乙醇和HBr,二者相对分子质量不等,故D错误.
故选A.
点评 本题考查有机物的结构和性质,侧重酯的水解及相对分子质量的考查,注意饱和一元醇与比它少1个C的一元羧酸的相对分子质量相同,题目难度不大.


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:解答题
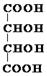 .
.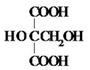 .M的核磁共振氢谱图中有4组吸收峰.
.M的核磁共振氢谱图中有4组吸收峰.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
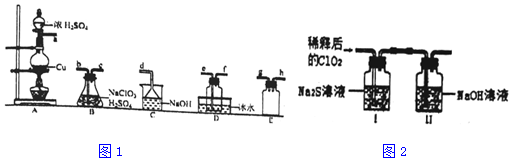
| 操作步骤 | 实验现象 | 结论 |
| 取少量I中溶液于试管甲中,滴加品红溶液和盐酸 | 品红始终不褪色 | ①无_SO2(或HSO3-或SO32-)生成 |
| 另取少量I中溶液于试管乙中,加入Ba(OH)2溶液,振荡 | ②白色沉淀 | 有SO42- |
| ③继续在试管乙中滴加Ba(OH)2溶液至过量,静置,取上层清液于试管丙中,________ | 有白色沉淀生成 | 有Cl-生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m、n | B. | 3、7 | C. | m-2、10-n | D. | m+2、n+10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
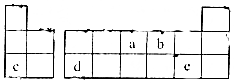
| A. | 气态氢化物的稳定性:a>b>c | |
| B. | 原子半径大小:a>b>c | |
| C. | c,d,e的氧化物对应的水化物之间两两皆能反应 | |
| D. | b、c形成的化合物中阴、阳离子的个数比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 L C12与足量铁粉反应转移的电子数为0.2NA | |
| B. | 2 L 0.1 mol•L-1Na2CO3溶液中所含CO32-的数目为0.2NA | |
| C. | 28 g C2H4所含共用电子对数目为4NA | |
| D. | 1 mol H2O中所含的中子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用加酶洗衣粉洗衣服时水的温度越高越好 | |
| B. | “光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化物有关 | |
| C. | 小苏打是制作馒头的膨松剂,苏打是治疗胃酸过多的抗酸剂 | |
| D. | 乙醇、过氧化氢、次氯酸钠等消毒液的消毒原理都是利用其强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com