
【题目】在不同温度下,向V L密闭容器中加入0.5 mol NO和0.5 mol活性炭,发生反应:
2NO(g)+C(s)![]() N2(g)+CO2(g) △H= —Q kJ·mol-1(Q>0),达到平衡时的数据如下:
N2(g)+CO2(g) △H= —Q kJ·mol-1(Q>0),达到平衡时的数据如下:
温度/℃ | n (C)/mol | n(CO2)/mol |
T1 | 0.15 | |
T2 | 0.375 |
下列有关说法正确的是
A. 由上述信息可推知:T1 > T2
B. T2℃时,若反应达平衡后再缩小容器的体积,c (N2):c (NO)增大
C. T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率增大
D. T1℃时,该反应的平衡常数![]()
【答案】D
【解析】试题分析:A.由于在温度是T1时反应消耗C的物质的量0.15mol,在温度是T2时反应消耗C的物质的量是0.125mol,说明平衡逆向移动。该反应的正反应是放热反应,根据平衡移动原理:升高温度,平衡向吸热反应方向移动,实验可推知:T1 < T2,错误;B.T2℃时,若反应达平衡后再缩小容器的体积,由于该反应是反应前后气体体积不变的反应,所以平衡不发生移动,c (N2):c (NO)不变,错误;C.T1℃时,若开始时反应物的用量均减小一半,由于该反应是反应前后气体体积不变的反应,所以平衡不发生移动,根据平衡移动移动可知平衡不发生移动,因此平衡后NO的转化率不变,错误;D.根据平衡常数的含义可知:T1℃时,该反应的平衡常数是K=c(N2)c(CO2)/c2(NO) =(0.15×0.15)÷0.352=0.184,正确。


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】利用电导法测定某浓度醋酸电离的ΔH、Ka随温度变化曲线关系如图。已知整个电离过程包括氢键断裂、醋酸分子解离、离子水合。下列有关说法不正确的是
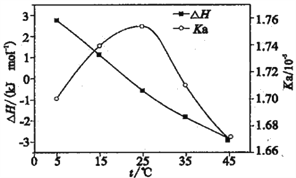
A. 理论上ΔH=0时,Ka最大
B. 25℃时,[CH3COOH]最大
C. 电离的热效应较小是因为分子解离吸收的能量与离子水合放出的能量相当
D. CH3COOH溶液中存在氢键是ΔH随温度升高而减小的主要原因
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月5日,中国首架按照国际标准研制,拥有自主知识产权的大型客机C-919在上海浦东机场首飞,科学家在实验室研究利用催化技术将飞机尾气中的NO和CO转变成CO2和N2,其反应为2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH<0。
N2(g)+2CO2(g) ΔH<0。
(1)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是____________。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
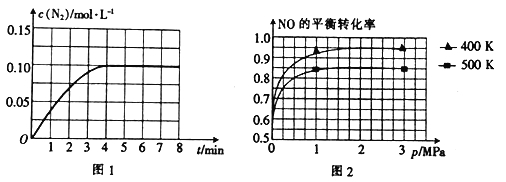
(2)若将1 molNO和2 mol CO通入2 L的恒容密闭容器中,在一定条件下发生上述反应,反应中生成的N2的物质的量浓度随时间的变化情况如图1所示。则NO从反应开始到平衡时的平均反应速率v(NO)=_________,4 min末CO的浓度为_____________ molL-1。
(3)已知上述反应中NO的平衡转化率与压强、温度的关系如图2所示。工业上催化装置比较适合的温度和压强是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2。

实验步骤如下:
①连接好实验装置,检查装置的气密性;
②把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量试管和药品的总质量为16.0g;
③加热,开始反应,直到不再有气体产生为止;
④测量排入量筒中水的体积为284.3mL,换算成标准状况下氧气的体积为279.0mL;
⑤准确称量试管和残留物的质量为15.6g。
根据上述实验过程,回答下列问题:
(1)如何检查装置的气密性?______.
(2)以下是测量收集到气体体积必须包括的几个步骤: ①调整量筒的高度使广口瓶和量筒内的液面高度相同;②使试管和广口瓶内气体都冷却至室温;③读取量筒内液体的体积,这三步操作的正确顺序是___________________________(请填写步骤代号),进行③的实验操作时,若仰视读数,则读取氧气的体积_______________(填“偏大”、“偏小”或“无影响”)。
(3)实验过程中产生氧气的物质的量是___________________mol;实验测得氧气的气体摩尔体积是____________L/mol(列出算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)3.01×1023个CO2分子中含______mol氧原子,在标准状况下其体积为______L,它与______gH2O含有相同的氧原子数。
(2)同温同压下,等质量的N2和CO2所含分子数比为______,体积比为______。
(3)某气体在标准状况下的密度为1.25gL-1,则28g该气体所含有的分子数为______。
(4)在标准状况下,22.4L由氮气和氧气组成的混合气体,其质量为30g,则其中氧气的质量为___g。
(5)同温同压下,同体积的H2和A气体的质量分别为1.0g和16.0g,则A的相对分子质量为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着氮氧化物对环境及人类活动影响的日趋严重,如何消除大气污染物中氮氧化物成为人们关注的主要问题之一。
Ⅰ.利用NH3的还原性可以消除氮氧化物的污染。
(1)请写出NH3的电子式________________。
(2)已知:①H2O(l)=H2O(g) △H1=+44.0kJ·mol-1
②N2(g)+O2(g)=2NO(g) △H2=+229.3 kJ·mol-1
③4NH3(g)+5O2(g)= 4NO(g)+6H2O(g)△H3=-906.5kJ·mol-1
则反应④4NH3(g)+6NO(g)= 5N2(g)+6H2O(l)的△H=_______;该反应的平衡常数K的表达式为__________;增加压强,该反应中NO的转化率将____________ (填“提高”、“不变”或“降低”)。
(3)一定温度下,在容积固定的密闭容器中,发生反应④,下列能判断该反应达到平衡的是____________ (填标号)
A.c(NH3)=c(N2) B.容器中压强不变
C.容器中混合气体的密度不变 D.1molN-H键断裂的同时,生成1molO-H键
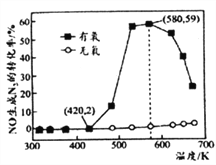
(4)某小组研究了NH3和NO在Ag2O催化剂表面发生上述反应④,其中NO在一定时间内的转化率随温度变化的结果如右图所示。在有氧条件下,温度580K之后NO生成N2的转化率降低的原因可能是____________。在温度为420~580K时,有氧条件下NO生成N2的转化率明显高于无氧条件的原因可能是____________。
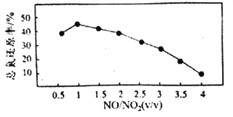
Ⅱ.用尿素[(NH2)2CO]水溶液吸收氮氧化物也是一种可行的方法。NO和NO2不同配比混合气通入尿素溶液中,总氨还原率与配比关系如右图。
(5)用尿素[(NH2)2CO]水溶液吸收体积比为1∶1的NO和NO2混合气,将N元素转变为对环境无害的气体写出该反应的化学方程式____________。
(6)随着NO和NO2配比的提高,总氮还原率降低的主要原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化属于加成反应的是( )
A.乙烯通入酸性高锰酸钾溶液中
B.乙烯通入溴水中
C.苯与液溴在FeBr3催化下反应
D.甲烷与氯气在一定条件下反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将6.4gSO2和8.0gSO3相比较,下列结论中错误的是
A.它们所含氧原子数目之比为2:3
B.它们的体积之比为1:1
C.它们所含原子数目之比为3:4
D.它们的分子数目之比为1:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com