
| A. | 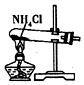 制取氧气 | B. | 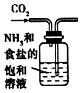 制取NaHCO | C. | 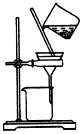 分离NaHCO3 | D. | 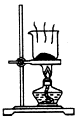 干燥NaHCO |
分析 A.氯化铵不稳定,加热易分解,温度稍低又可生成氯化铵;
B.气体通入方向错误;
C.从溶液中分离碳酸氢钠固体,可用过滤的方法;
D.碳酸氢钠不稳定,不能直接加热干燥.
解答 解:A.氯化铵不稳定,加热易分解,温度稍低又可生成氯化铵,制备氨气,应用氯化铵和氢氧化钙为反应物,故A错误;
B.应将二氧化碳从长导管进入,否则将液体排出,故B错误;
C.从溶液中分离碳酸氢钠固体,可用过滤的方法,故C正确;
D.碳酸氢钠不稳定,不能直接加热干燥,可烘干,故D错误.
故选C.
点评 本题考查较为综合,涉及物质的分离、提纯以及制备,为高考常见题型,侧重于学生的分析、实验能力的考查,注意把握实验的严密性和可行性的评价,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 推广使用一次性木筷,减少疾病传染 | |
| B. | 将地沟油回收重新加工为食用油,提高资源的利用率 | |
| C. | 推广使用电动汽车、天然气汽车等公共交通工具,保护环境 | |
| D. | 推广使用煤的气化、液化技术可减少二氧化碳等温室气体的排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 乙烯和H2生成乙烷的反应△H>0 | |
| B. | 加入催化剂,降低了E活,并减小了反应的△H | |
| C. | 图1表明,催化加氢过程中催化剂参与反应过程并形成不稳定的中间体 | |
| D. | 图2表明,催化加氢过程中催化剂将较难发生的反应分成了多个容易发生的反应,可提高反应物的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是( )
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是( )| 选项 | W | X |
| A | 稀硫酸 | Na[Al(OH)4]溶液 |
| B | 稀硝酸 | Fe |
| C | CO2 | Ca(OH)2溶液 |
| D | Cl2 | Fe |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题


| A.气体M是SO2和H2的混合物 | B.气体M是SO2和H2的体积比为4:1 |
| C.反应中共消耗锌97.5g | D.反应中共转移电子3mol |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
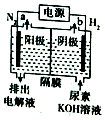 用如图所示的装置,采用廉价的镍催化剂,通过电化学方法,可在碱性环境中直接使尿素转化成纯氢,电极为惰性电极,隔膜仅阻止气体通过,下列相关叙述不正确的是( )
用如图所示的装置,采用廉价的镍催化剂,通过电化学方法,可在碱性环境中直接使尿素转化成纯氢,电极为惰性电极,隔膜仅阻止气体通过,下列相关叙述不正确的是( )| A. | 尿素由碳、氮、氧、氢四种元素组成的有机化合物 | |
| B. | 尿素在阳极被氧化,当生成1 mol N2时,转移电子为6 mol | |
| C. | a、b两处生成的气体体积比为1:3 | |
| D. | 假设电解过程中溶液体积不变,电解后排出液的pH比通入前大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 向甲乙两个容积均为1L的恒容容器中,分别充入2moLA、2molB和1molA、1molB.相同条件下,发生下列反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示:下列说法正确的是( )
向甲乙两个容积均为1L的恒容容器中,分别充入2moLA、2molB和1molA、1molB.相同条件下,发生下列反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示:下列说法正确的是( )| A. | X可能等于2也可能等于3 | |
| B. | 向平衡后的乙容器中充入氦气可使c(A)增大 | |
| C. | 向甲容器中再充入2molA、2molB,则平衡时甲容器中0.78mol•L-1<c(A)<1.56mol•L-1 | |
| D. | 将乙容器单独升温可使乙容器内各物质的体积分数与甲容器内的相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com