
| A. | 稀KOH溶液 | B. | HCl溶液 | C. | CuSO4溶液 | D. | NaCl溶液 |
科目:高中化学 来源: 题型:多选题

| A. | 气体1可能为NO和CO2的混合物 | |
| B. | 沉淀3可能为Mg(OH)2和Al(OH)3的混合物 | |
| C. | 沉淀4可能为BaCO3、BaSO3或二者混合物 | |
| D. | 固体粉末X中一定有Na2CO3,可能有KAlO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
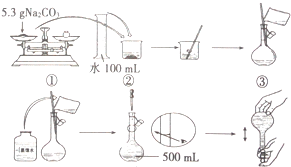 某兴趣小组为探究Na2CO3溶液的性质,需要480mL0.2mol•L-1的Na2CO3溶液.溶液的配制过程如图所示:
某兴趣小组为探究Na2CO3溶液的性质,需要480mL0.2mol•L-1的Na2CO3溶液.溶液的配制过程如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+Cl2 $\stackrel{光}{→}$CH3Cl+HCl | |
| B. | 2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O | |
| C. | CH3CH2OH+CH3C00H$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O | |
| D. | CH2═CH2+Br2→BrCH2CH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电子由铁棒通过导线流向铜棒 | B. | 正极反应为Fe-2e-═Fe2+ | ||
| C. | 铜棒逐渐溶解 | D. | 该装置能将电能转化为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO在反应中作还原剂 | |
| B. | 氧化剂和还原剂的物质的量比为1:3 | |
| C. | FeCl2发生还原反应 | |
| D. | 0.5molFeCl2发生反应,转移电子1.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | OH-+S2-+2H+→HS-+H2O | B. | 2OH-+S2-+4H+→H2S↑+2H2O | ||
| C. | 2OH-+S2-+3H+→HS-+2H2O | D. | OH-+S2-+3H+→H2S↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com