
分析 (1)醋酸为弱酸,将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,恰好生成醋酸钠,为强碱弱酸盐,溶液呈碱性,结合电荷守恒分析;
(2)根据溶液中电荷守恒及醋酸根离子与钠离子浓度相等进行判断氢离子与氢氧根离子浓度关系;
(3)醋酸为弱电解质,溶液中部分电离出氢离子,等体积的两溶液混合pH=7,若m=n,溶液显示中性,则醋酸浓度稍大;
(4)根据c(酸)=$\frac{c(碱)×V(碱)}{V(酸)}$判断不当操作对相关物理量的影响.
解答 解:(1)醋酸为弱电解质,将等体积、等物质的量浓度的醋酸和氢氧化钠溶液混合后,恰好生成CH3COONa,为强碱弱酸盐,溶液显碱性,溶液中存在电荷守恒:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),显碱性,即c(H+)<c(OH-),所以c(Na+)>c(CH3COO-);
故答案为:碱性;>;
(2)将物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中存在电荷守恒:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),溶液中醋酸根离子和钠离子浓度相等,则氢离子与氢氧根离子浓度相等,所以溶液呈中性;二者等体积恰好反应生成醋酸钠,为强碱弱酸盐,溶液呈碱性,若显中性,则醋酸稍过量,即醋酸体积>氢氧化钠溶液体积;
故答案为:中性;>;
(3)将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后溶液的pH=7,当m=n时,两溶液恰好反应生成醋酸钠,溶液显示碱性,若使溶液的pH=7,则醋酸的浓度应该稍大一些,即m>n;由于醋酸为弱酸,则溶液中氢离子浓度小于氢氧化钠溶液中氢氧根离子浓度,即c(H+)<氢氧化钠溶液中c(OH-),
故答案为:<;>;
(4)解:A.配制标准溶液的NaOH中混有Na2CO3杂质,以酚酞为指示剂时等质量的氢氧化钠和Na2CO3消耗的酸前者大,所以标准溶液的氢氧化钠中混有Na2CO3杂质时造成V(碱)偏大,根据c(酸)=$\frac{c(碱)×V(碱)}{V(酸)}$,可知c(酸)偏大,故A正确;
B.滴定终点读数时,俯视滴定管的刻度,V(碱)偏小,根据c(酸)=$\frac{c(碱)×V(碱)}{V(酸)}$,可知c(酸)偏小,故B错误;
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗,待测液的物质的量不变,则V(碱)不变,根据c(酸)=$\frac{c(碱)×V(碱)}{V(酸)}$,可知c(酸)不变,故C错误;
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液,造成V(碱)偏高,根据c(酸)=$\frac{c(碱)×V(碱)}{V(酸)}$,可知c(酸)偏高,故D正确;
E.未用标准液润洗碱式滴定管,标准液碱的浓度偏小,造成V(碱)偏高,根据c(酸)=$\frac{c(碱)×V(碱)}{V(酸)}$,可知c(酸)偏高,故E正确;
故答案为:ADE.
点评 本题考查酸碱混合以及溶液pH的大小比较、中和滴定中的误差分析,题目难度中等,本题注意从溶液电中性的角度比较溶液离子浓度的大小关系,另外把握盐类水解的原理及其应用方法,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:解答题
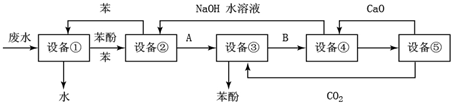 回答下列问题:
回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素X:它的原子中第三电子层比第二电子层少2个电子 | |
| B. | 元素Y:它的二价阳离子核外电子总数与氩原子相同 | |
| C. | 元素Z:位于元素周期表中的第3周期,ⅢA族 | |
| D. | 元素W:它的单质硬度最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯与浓硝酸、浓硫酸共热并保持55℃-60℃反应生成硝基苯 | |
| B. | 苯在合适条件下催化加氢可生成环己烷 | |
| C. | 丙烯与溴的四氯化碳溶液反应生成1,2-二溴丙烷 | |
| D. | 甲苯与溴蒸气在光照条件下反应主要生成邻溴甲苯和对溴甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
.| 实验步骤 | 实验现象 | 结论与化学反应方程式 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com