
【题目】NA 代表阿伏加德罗常数的值,下列说法正确的是( )
A. 1mol O2 作为氧化剂参与反应,得到的电子数一定为 4NA
B. 1mol Fe 和足量稀硫酸反应,失去的电子数是 3NA
C. 0.4mol·L-1Na2SO4 溶液中,所含 Na+和SO42- 总数为 1.2NA
D. 标准状况下,23g Na 所占的体积一定小于 22.4L
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】下列各种变化中,不属于化学变化的是
A. 电解熔融氧化铝的过程
B. 加热胆矾得到白色的无水硫酸铜粉末
C. 向沸水中滴入饱和氯化铁溶液,制取氢氧化铁胶体
D. .向蛋清溶液中滴入饱和硫酸钠溶液,盐析出白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的单质及一些化合物在工农业生产等领域有重要作用,回答下列问题
(1)N原子核外有________不同运动状态的电子。基态N原子中,能量最高的电子所占据的原子轨道形状为_____________________;
(2)N与同一周期中左右相邻的两种元素原子的第一电离能大小关系为______________(填元素名称),该电离能大小变化的原因为______________________________________________;
(3)经测定发现,N2O5固体由NO2+和NO3-两种离子组成,该固体中N原子杂化类型为____________________;与NO2+互为等电子体的微粒有_______________(写出一种)。
(4)含氮的某些配体可与Co3+配位,请判断Co元素位于元素周期表中的____________区(填s、p、d、ds或f),试写出该Co元素基态原子的核外电子排布式________________________;Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co3+的配位数为_______________。已知配体N3-与CO2为等电子体,判断N3-的空间立体构型为_____________________。
(5)已知N的电负性大于Cl,NCl3能与水发生剧烈的水解反应,反应得到两种高中常见的化学物质,则发生的化学方程式为_______________________________________________。
(6)由H、C、N、O四种元素共同组成的四原子分子具有多种不同的结构,请写出其中两种满足稳定结构的链状异构体的电子式____________________、______________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素a、b、c、d原子序数依次增大,b元素的一种同位素可用于考古年代鉴定。甲、乙分别是元素b、d的单质,通常甲为固体,乙为气体,O.OOl mol/L的丙溶液pH=3;W、X、Y均是由这些元素构成的二元化台物,Y是形成酸雨的主要物质之一。上述物质的转化关系如图,下列说法正确的是( )

A. 原子半径:b
B. a、c、d形成的化台物一定是共价化合物
C. W、X、Y中X的熔沸点最高
D. Y、Z均可用排水法收集
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO32-、NO3-等微粒它们的价电子总数都是________,因此它们与由ⅥA族两元素组成的________分子的结构相同,呈________形,CO32-中心原子的价层电子对数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,X 表示某物质,Y 表示 X 物质中含有的少量杂质,Z 表示要除去杂质加入的试剂,其中正确的组别是

A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 在NH![]() 和[Cu(NH3)4]2+中都存在配位键
和[Cu(NH3)4]2+中都存在配位键
B. 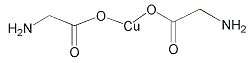 σ键和π键比例为7:1
σ键和π键比例为7:1
C. C![]() 与O
与O![]() 互为等电子体,1 mol O
互为等电子体,1 mol O![]() 中含有的π键数目为2NA
中含有的π键数目为2NA
D. 已知反应N2O4(l)+2N2H4(l)===3N2(g)+4H2O(l),若该反应中有4 mol N—H键断裂,则形成的π键数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T1时,在三个容积均为1 L的恒容密闭容器中仅发生反应:2NO2(g)![]() 2NO(g)+O2 (g) (正反应吸热)。实验测得: v正= v(NO2)消耗=k正c2(NO2 ),v逆= v(NO)消耗=2v(O2)消耗= k逆c2 (NO)·c(O2 ),k正、k逆为速率常数,受温度影响。下列说法正确的是
2NO(g)+O2 (g) (正反应吸热)。实验测得: v正= v(NO2)消耗=k正c2(NO2 ),v逆= v(NO)消耗=2v(O2)消耗= k逆c2 (NO)·c(O2 ),k正、k逆为速率常数,受温度影响。下列说法正确的是
容器编号 | 物质的起始浓度(mol·L-1) | 物质的平衡浓度(mol·L-1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
I | 0.6 | 0 | 0 | 0.2 |
II | 0.3 | 0.5 | 0.2 | |
Ⅲ | 0 | 0.5 | 0.35 | |
A. 达平衡时,容器I与容器Ⅱ中的总压强之比为 4∶5
B. 达平衡时,容器中Ⅱ中 c(O2)/ c(NO2) 比容器I中的大
C. 达平衡时,容器Ⅲ中NO的体积分数小于50%
D. 当温度改变为 T2时,若 k正=k逆,则 T2<T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A. 标准状况下,0.1moLCl2溶于水,转移的电子数目为0.1NA
B. 标准状况下,22.4 L H2O含有的分子数为NA
C. 1.8g D2O含有的电子数为0.1NA
D. 常温常压下,1.06 g Na2CO3含有的Na+数为0.02NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com