
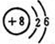
| A. | s区 | B. | p区 | C. | d区 | D. | f区 |
科目:高中化学 来源: 题型:选择题
| A. | 缩小体积使压强增大 | B. | 体积不变充入稀有气体使压强增大 | ||
| C. | 体积不变充入He使压强增大 | D. | 压强不变充入稀有气体氖 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
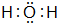 、
、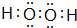 ,属于共价化合物.
,属于共价化合物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | ①能使溴的四氯化碳溶液褪色; ②比例模型为:  ③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成; ②球棍模型为: 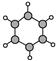 |
| C | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与E反应生成相对分子质量为100的酯. |
| D | ①相对分子质量比C少2; ②能由C氧化而成; |
| E | ①由C、H、O三种元素组成; ②球棍模型为: 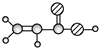 |
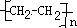 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ①②④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 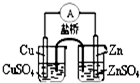 能组成Zn、Cu原电池 | B. |  能证明非金属性C>Si | ||
| C. | 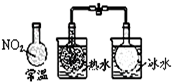 说明反应2NO2?N2O4△H>0 | D. | 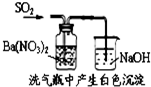 白色沉淀为BaSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 适量浓H2SO4 | B. | 硫酸钾固体 | C. | 醋酸钠固体 | D. | 硝酸钾溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com