
����Ŀ����1��0.2molij��A����������ȫȼ�պ�����CO2��H2O��1.2mol���Իش�
������A����ʹ��ˮ��ɫ������һ��������������������ȡ����Ӧ����һ��ȡ����ֻ��һ�֣�����A�Ľṹ��ʽΪ________��
�� ����A��ʹ��ˮ��ɫ���ڴ��������£���H2�ӳɷ�Ӧ������2��2���������飬����A��������_______���ṹ��ʽ��______��
�۱���A������̼ԭ������ʹ��ˮ��ɫ��A��ͬϵ����__��ͬ���칹��
��2�����з����У���˴Ź���������ֻ��һ�ַ壨�źţ���������_____��
A. CH3��CH3 B. CH3COOH C. CH3COOCH3 D. CH3COCH3
��3��������A��B�ķ���ʽ����C2H4Br2��A�ĺ˴Ź���������ͼ1��ʾ����A�Ľṹ��ʽΪ_______��
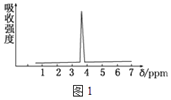
��4��ij������Ľṹʽ������ʽ�������ģ����ͼ2�����л����ӵĺ˴Ź�������ͼ��ͼ3����λ��ppm�� �����й��ڸ��л����������ȷ����_______��

A. ���л��ﲻͬ��ѧ��������ԭ����8��
B. ���л������ڷ����廯��������ڷ�
C. ����ʽ�е�Et�����Ļ���Ϊ��CH3
D. ���л�����һ���������ܹ�������ȥ��Ӧ
���𰸡�![]() 3��3-����-1-��ϩ (CH3)3C-CH=CH2 3 AD CH2BrCH2Br AD
3��3-����-1-��ϩ (CH3)3C-CH=CH2 3 AD CH2BrCH2Br AD
��������
(1)��ȼ�����ɶ�����̼��ˮ������0.2mol��ȼ�����ɶ�����̼��ˮ��1.2mol�жϷ����е�̼ԭ�Ӻ���ԭ�ӣ��ݴ�ȷ������ʽΪC6H12��������A����ʹ��ˮ��ɫ������һ�������£�����Cl2����ȡ����Ӧ����һ�ȴ���ֻ��һ�֣�˵�����в���̼̼˫����ӦΪ��������������A��ʹ��ˮ��ɫ���ڴ��������£���H2�ӳɷ�Ӧ������2��2-�������飬A�к���̼̼˫�����۱���A������̼ԭ������ʹ��ˮ��ɫ��A��ͬϵ��Ϊ��ϩ������ͬ���칹�����д�����������
(2)�˴Ź���������ֻ��һ�ַ壬˵���ṹ�Գƣ�ֻ����1����ԭ�ӣ��ݴ˷������(2)��(3)��
(4)���ݸ��л�������ģ�ͺͺ˴Ź����������жϡ�
(1)ij��A 0.2mol ����������ȫȼ�պ�����CO2��H2O��1.2mol��������к���N(C)=6��N(H)=12������ʽΪC6H12��
��C6H12ֻ��1�������Ͷȣ�����A����ʹ��ˮ��ɫ������Ϊ�����������У�������������ȡ����Ӧ����һ�ȴ���ֻ��һ�ֵ��ǻ����飬��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
������A��ʹ��ˮ��ɫ���ڴ��������£���H2�ӳɷ�Ӧ������2��2-�������飬A�к���̼̼˫����ӦΪ(CH3)3C-CH=CH2������Ϊ3��3-����-1-��ϩ���ʴ�Ϊ��3��3-����-1-��ϩ��(CH3)3C-CH=CH2��
�۱���A������̼ԭ������ʹ��ˮ��ɫ��A��ͬϵ��Ϊ��ϩ����Ӧ��ͬ���칹����CH2=CHCH2CH3��CH3CH=CHCH3��CH3C(CH3)=CH2��������ͬ���칹�壬�ʴ�Ϊ��3��
(2)A��CH3-CH3�ṹ�Գƣ�����һ����ԭ�ӣ��˴Ź���������ֻ��һ���壬��A��ȷ��B��CH3COOH����2����ԭ�ӣ��˴Ź���������ֻ�������壬��B����C��CH3COOCH3����2����ԭ�ӣ��˴Ź���������ֻ�������壬��C����D��CH3COCH3�ṹ�Գƣ�����1����ԭ�ӣ��˴Ź���������ֻ��һ���壬��D��ȷ���ʴ�Ϊ��AD��
(3)������A��B�ķ���ʽ����C2H4Br2��A�ĺ˴Ź�������ֻ��һ���壬A��ֻ��һ��Hԭ�ӣ��ṹ�Գƣ���AΪCH2BrCH2Br���ʴ�Ϊ��CH2BrCH2Br��
(4)A�����л���ṹ���Գƣ���8��λ�õ�Hԭ�ӣ����Ժ˴Ź�����ͼ����8�ַ壬��A��ȷ��B�����л����в��������������ڷ����廯�����B����C���ɽṹ�����ģ�Ϳ�֪��Et����-CH2CH3����C����D���ṹ�к�-OH������-OH������C����λC�Ϻ�H��������һ���������ܹ�������ȥ��Ӧ����D��ȷ���ʴ�Ϊ��AD��


 ���ɶ���ܲ��¿�ֱͨ��Уϵ�д�
���ɶ���ܲ��¿�ֱͨ��Уϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̼�����������������й㷺���ڣ�Andren Dasic�������M+����������N2OΪ����������������ϩ������ȩ������ϵ������ԭѭ����ͼ��ʾ����ش��������⡣
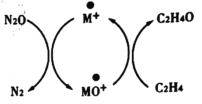
(1)��֪N2O(g)+M+(s)=N2(g)+MO+(s) ��H1=+678kJ��mol-1
MO+(s)+C2H4(g)=C2H4O(g)+M+(s) ��H2=-283kJ��mol-1
��д����M+����������N2OΪ������������ϩ������ȩ���Ȼ�ѧ����ʽ��_________
(2)��֪�ں�������I2��Һ�У���ӦCH3CHO (aq)![]() CH4 (g) +CO (g)���������У���������ӦCH3CHO (aq) +I2 (aq) ��CH3I (l) +HI (aq) +CO (g) (����Ӧ)����II��Ϊ�췴Ӧ��
CH4 (g) +CO (g)���������У���������ӦCH3CHO (aq) +I2 (aq) ��CH3I (l) +HI (aq) +CO (g) (����Ӧ)����II��Ϊ�췴Ӧ��
�پ����˷�Ӧ�������ǵ�______(����������II��)����Ӧ
����д����II����Ӧ�Ļ�ѧ����ʽ��_________
(3)����������ԭ�ӵĽ������OA��ʾ����ԭ����N2����N2O�Ľ����OA(N2) =167.4 kJ��mol-1�� ��ԭ������ϩ������ȩ�Ľ����OA (C2H4) = 473 kJ��mol-1��������÷�Ӧ������M+����ԭ�ӵĵĽ����OA (M+)��ֵӦ����________��ʹ�ô�����ʹ�÷�Ӧ�Ļ��________ (������������ ����С������������)��
(4)ij2L�����з���: 2CO2(g)![]() 2CO (g)+O2 (g)��2molCO2�ڲ�ͬ�¶���ƽ��ֽ�������ͼ��ʾ��
2CO (g)+O2 (g)��2molCO2�ڲ�ͬ�¶���ƽ��ֽ�������ͼ��ʾ��
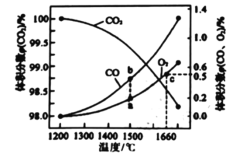
�ٺ��º��������£��ܱ�ʾ�ÿ��淴Ӧ�ﵽƽ��״̬����______(����)
A.CO���������O2��������ı�ֵ���ֲ���
B.�����ڻ��������ܶȱ��ֲ���
C.�����ڻ�������ƽ��Ħ���������ֲ���
D.������̼Ԫ�ص������������ֲ���
��ͼ��a��b��c�����ƽ�ⳣ��K(a)��K(b)��K(c)�Ĵ�С��ϵΪ_______
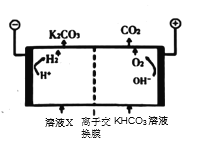
��Ϊʵ��CO2���ţ�Ŀǰ�ϳ���ķ������ø�Ũ�ȵ�K2CO3��Һ���չ�ҵ�����е�CO2������ҺX�������õ�ⷨʹK2CO3��Һ��������װ��ʾ��ͼ��ͼ���ñ�Ҫ�����ֺͻ�ѧ�������![]() ��������������ԭ��____________��
��������������ԭ��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ϊ����һ�������������仯�������������й㷺Ӧ�á��ش��������⣺
(1)��̬Fe3+�ĵ����Ų�ʽΪ________��
(2)ʵ������KSCN��Һ������(![]() )����Fe3+��N��O��S�ĵ�һ�������ɴ�С��˳��Ϊ_______(��Ԫ�ط��ű�ʾ)��������̼ԭ�ӵ��ӻ��������Ϊ______��
)����Fe3+��N��O��S�ĵ�һ�������ɴ�С��˳��Ϊ_______(��Ԫ�ط��ű�ʾ)��������̼ԭ�ӵ��ӻ��������Ϊ______��
(3)FeCl3���۵�Ϊ306�棬�е�Ϊ315�� FeCl3�ľ���������______��FeSO4������������SO42-�����幹����_______��
(4)�ʻ���[Fe(CO)5]���������������Ϳ������ȣ�1 mol Fe(CO)5�����к�������ĿΪ_______����CO��Ϊ�ȵ������������__________(�ѧʽ��дһ��)
(5)����������ľ���ṹʾ��ͼ��ͼ��ʾ���þ�������������������֮��Ϊ______��
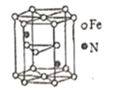
(6)������������ľ�����ͼ��ʾ����֪����������������ܶ�Ϊ��g��cm-1��NA���������ӵ�������ֵ���ڸþ����У���Fe2+�����ҵȾ����Fe2+��ĿΪ_____��Fe2+��O2-����̼��Ϊ_______ pm��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������NH3����һ����Ҫ�Ļ���ԭ�ϣ��㷺Ӧ�����Ƶ��ʡ���ҩ���ϳ���ά�ȡ���ش��������⣺
��1��2molNH3�ڱ�״���µ������___��
��2��2molNH3��������___������������Ԫ�ص�������___��
��3��2molNH3�����İ�������Ϊ___��������Ϊ___��
��4����ҵ���÷�ӦN2+3H2 ![]() 2NH3���ϳɰ����������Ƶ�2molNH3����״���²��뷴Ӧ��H2�����Ϊ___��14��N2���뷴Ӧ�ɵ�NH3���ʵ���Ϊ___��
2NH3���ϳɰ����������Ƶ�2molNH3����״���²��뷴Ӧ��H2�����Ϊ___��14��N2���뷴Ӧ�ɵ�NH3���ʵ���Ϊ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ��Ϊ�ؿ��к�����ߵ�Ԫ�أ����γɶ�����Ҫ�ĵ��ʺͻ����
(1)��Ԫ��λ��Ԫ�����ڱ���___________�����ڶ�����Ԫ���У���һ�����ܱ��������___________�֡�
(2)O3������������O3������ԭ�ӵ��ӻ���ʽΪ___________������ӵ� VSEPRģ��Ϊ___________�����以Ϊ�ȵ����������Ϊ___________(д��һ�ּ���)��
(3)�����л����У���ԭ�ӵijɼ���ʽ��ͬ�ᵼ���л������ʲ�ͬ������C2H5OH�ķе����CH3OCH3��ԭ��Ϊ___________��C2H5OH��������ˮCaCl2ǧ������ΪCa2+��C2H5OH���γ�[Ca(C2H5OH)4]2+�������ӵĽṹʽ�ɱ�ʾΪ______________________��
(4)��Ԫ�ؿɷֱ���Fe��Cu�γɵͼ�̬������FeO��Cu2O��

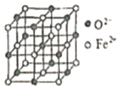
��FeO���������ṹ��ͼ1��ʾ����Fe2+����λ��Ϊ___________����O2�����ڵ�����Fe2+���ɵļ��ι���Ϊ___________��
��Cu2O���������ṹ��ͼ2��ʾ����O2����Cu+֮���������Ϊa pm����þ�����ܶ�Ϊ___________g��cm��3��(�ú�a��NA�Ĵ���ʽ��ʾ��NA���������ӵ�������ֵ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij�����ܱ������м���1.6 mol L-1��NO2�ᷢ�����·�Ӧ��2NO2(g)N2O4(g) ��H =-56.9kJmol-1������N2O4�����ʵ���Ũ����ʱ��ı仯��ͼ��ʾ������˵������ȷ����

A.�����¶ȣ�60s�������л��������ɫ����
B.0-60s�ڣ�NO2��ת����Ϊ75%
C.0-60s�ڣ�v(NO2)=0.02mol L-1 s-1
D.a��b��ʱ������NO2������v(a)>v(b)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ��ˮ�г�����һ������Cr2O72-��CrO42-�����ǻ�����༰��̬ϵͳ�����ܴ�Σ����������д��������õĴ������������֣�����1����ԭ��������
�÷��Ĺ�������Ϊ��
���еڢٲ�����ƽ��2CrO42����ɫ��+2H+Cr2O32����ɫ��+H2O
��1����ƽ����ϵ��pH=2������Һ��______ɫ��
��2����˵���ڢٲ���Ӧ��ƽ��״̬����_____������ţ�
A��Cr2O72��CrO42��Ũ����ͬ
B��2v��Cr2O72��=v��CrO42��
C����Һ����ɫ����
��3���ڢڲ��У���ԭ1molCr2O72���ӣ���Ҫ______mol��FeSO47H2O��
��4���ڢ۲����ɵ�Cr��OH��3����Һ�д������³����ܽ�ƽ�⣺Cr��OH��3��s��Cr3+��aq��+3OH-��aq���������£�Cr��OH��3���ܶȻ�Ksp=c��Cr3+��c3��OH-��=10-32��Ҫʹc��Cr3+������10-5mol/L����Һ��pHӦ����______��
����2����ⷨ��
�÷���Fe���缫��⺬Cr2O72�����Է�ˮ�����ŵ��Ľ��У�������������ҺpH���ߣ�����
Cr��OH��3������
��5����Fe���缫��ԭ��Ϊ______���õ缫��Ӧʽ���ͣ���
��6��������������ҺpH���ߣ���Һ��ͬʱ���ɵij�������______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ȷ�Ӧ������һ����Ҫ���ʣ���������;ʮ�ֹ㷺�����������ں��Ӹֹ죬���һ���������ұ�����۵�Ľ����緰�������̵ȡ�


��1��ijУ��ѧ��ȤС��ͬѧ��ȡ�������������̲��е�ʵ��װ��(��ͼ��)�������ȷ�Ӧ�������׳�ۡ�ָ��ʹ��þ��������ص�Ŀ���� ______________________��
��2��ijͬѧ��ͼ��װ�ý������ȷ�Ӧ��ȡ��Ӧ��ġ����顱�������ᣬ�����еμ�KSCN��Һ����Һδ��Ѫ��ɫ��Ϊ�ⶨ��ʵ������ �����顱����Ԫ�غ��������ʵ��������ͼ��ʾ��

�����������↑ʼ��������ȫ������pH���±���ʾ��
Fe2+ | Fe3+ | Al3+ | Mg2+ | |
��ʼ����ʱ��pH | 7.5 | 2.8 | 4.2 | 9.6 |
������ȫʱ��pH | 9.0 | 4.0 | 5 | 11 |
�� �Լ�AӦѡ��________���Լ�BӦѡ��_______��(�����)
A��ϡ���� B�������� C��H2O2��Һ D����ˮ
�� д����Ӧ������ӷ���ʽ_____________________��
�� ��Ƽ�ʵ��֤��M�ijɷ���Fe2O3����Fe3O4��
���� | Ԥ������ |
ȡ����M�������Թ��У������м���________________���۲졣 | ������ȫ�ܽ⣬��Һ�ʻ�ɫ�� |
������������Һ�е���_________________���۲� | ______________________ |
�� ����ʵ��Ӧ������M�������䣬����֤��M��������ı�־��____________��
�� �����պ�ɫ��δM������Ϊ12.0 g����á����顱�Ĵ�����_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ������װ�ü���Cl2�����ʡ�
|
|
|
�� |
| �� |
��1��Iͼ����ɫ����______���a����b������Iͼ�ձ��з�����Ӧ�����ӷ���ʽ��______��
��2����ͼ�е�������_________��
��3����ͭ˿������˿������ʵ�飬���Ҳ�ܵ�ȼ������Ϊ��˿Ҳ�ܵ�ȼ��������_______����ѡ����ĸ����
A Fe��Cu���ǽ���Ԫ�� B Fe���۵��Cu��
C Fe���ܶȱ�CuС D Fe�����ʱ�Cu����
��4������װ�÷����ڹ����ĵط����չ�û��ֱ����������һ�������Ͳ�ڻ���ɫ������ɫ��dz����Ͳ��Һ�������ȡ������������������Ϊ60%������֪��������������52.8%�����ղ��ᷢ����ը��
����Ͳ��Һ��������ԭ����_________��
��ˮ���ñ���ʳ��ˮ������ˮ��ԭ����_________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com