
分析 (1)反应中Xe元素化合价由XeO3+6价降低为Xe中0价,总共降低6价,Mn元素化合价由Mn2+中+2价升高为MnO4-中+7价,总共升高5价,化合价最小公倍数为30,故XeO3系数为5,故Mn2+系数为6,再结合原子守恒配平;
(2)反应中Mn2+转化为MnO4-,溶液显紫红色;
(3)还原剂发生氧化反应,所含元素化合价升高的物质为还原剂被氧化;
(4)①根据n=cV计算n(Mn2+),反应中Mn元素化合价由Mn2+中+2价升高为MnO4-中+7价,转移电子物质的量为5n(Mn2+);
②根据n(Mn2+)计算生成n(H+),根据c=$\frac{n}{V}$计算c(H+),再根据pH=-lgc(H+)计算.
解答 解:(1)反应中Xe元素化合价由XeO3+6价降低为Xe中0价,总共降低6价,Mn元素化合价由Mn2+中+2价升高为MnO4-中+7价,总共升高5价,化合价最小公倍数为30,故XeO3系数为5,故Mn2+系数为6,再结合原子守恒配平后方程式为5XeO3+6Mn2++9H2O=6MnO4-+5Xe↑+18H+,故答案为:5;6;9;6;5;18;
(2)反应中Mn2+转化为MnO4-,溶液显紫红色,故答案为:溶液显紫红色;
(3)还原剂被氧化,反应中Mn元素化合价由Mn2+中+2价升高为MnO4-中+7价被氧化,故答案为:Mn;
(4)①n(Mn2+)=0.03L×0.1mol•L-1=0.003mol,反应中Mn元素化合价由Mn2+中+2价升高为MnO4-中+7价,转移电子物质的量为5n(Mn2+)=5×0.003mol=0.015mol,故答案为:0.015mol;
②由两方程式可知n(H+)=3n(Mn2+)=3×0.003mol=0.009mol,溶液稀释至90mL后,溶液中c(H+)=$\frac{0.009mol}{0.09L}$=0.1mol/L,故溶液的pH=-logc(H+)=-log0.1=1,故答案为:1.
点评 本题考查氧化还原反应的基本概念、配平、计算等,难度中等,注意掌握氧化还原反应配平常用的一些方法,计算中守恒思想的运用.


 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Ca2+、Al3+、HCO3-、Cl- | B. | K+、Ba2+、Cl-、NO3- | ||
| C. | Na+、AlO2-、OH-、SO42- | D. | Na+、NH4+、Cl-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH[H2O] | B. | CuCl2[CuSO4] | C. | NaCl[NaCl] | D. | CuSO4[Cu(OH)2] |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | N≡O | Cl-Cl | Cl-N | N═O |
| 键能/kJ•mol-1 | 630 | 243 | a | 607 |
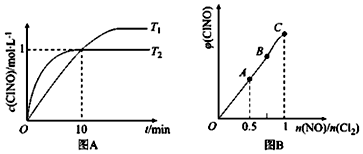
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
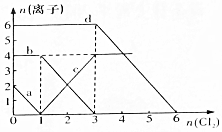 已知Cl-、Br-、Fe2+、I-的还原性依次增强.现向FeBr2、FeI2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示,请回答:
已知Cl-、Br-、Fe2+、I-的还原性依次增强.现向FeBr2、FeI2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示,请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com