
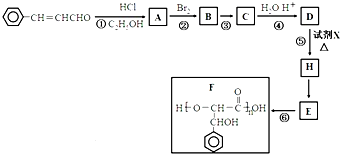
 3-������ϩȩ��һ�ֱ��㷺Ӧ����ʳƷ�ӹ��еĸ�Ч�Ͷ�ʳƷ���Ӽ�������������ϳɾ���F��·��ʾ��ͼ��
3-������ϩȩ��һ�ֱ��㷺Ӧ����ʳƷ�ӹ��еĸ�Ч�Ͷ�ʳƷ���Ӽ�������������ϳɾ���F��·��ʾ��ͼ��
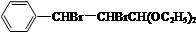 +2NaOH$��_{��}^{H_{2}O}$
+2NaOH$��_{��}^{H_{2}O}$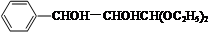 +2NaBr��
+2NaBr�� +2Ag��NH3��2OH$\stackrel{��}{��}$
+2Ag��NH3��2OH$\stackrel{��}{��}$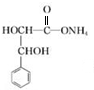 +2Ag��+3NH3+H2O��
+2Ag��+3NH3+H2O�� ��
�� �� ����дһ�֣�
�� ����дһ�֣� �����Լױ�����ȩΪԭ���Ʊ�3-������ϩȩ
�����Լױ�����ȩΪԭ���Ʊ�3-������ϩȩ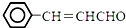 ����ƺϳ���·�������Լ���ѡ�����ϳ���·ʾ��ͼʾ�����£�
����ƺϳ���·�������Լ���ѡ�����ϳ���·ʾ��ͼʾ�����£����� 3-������ϩȩ������Ϣ�еķ�Ӧ����AΪ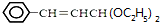 ��A���巢���ӳɷ�Ӧ����BΪ
��A���巢���ӳɷ�Ӧ����BΪ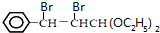 ����F�Ľṹ��֪EΪ
����F�Ľṹ��֪EΪ ���Լ�XΪ������Һ��D��������Һ��Ӧ�õ�H��H�ữ�õ�E����DΪ
���Լ�XΪ������Һ��D��������Һ��Ӧ�õ�H��H�ữ�õ�E����DΪ ��HΪ
��HΪ ���B��D�Ľṹ��֪B����±������ˮ������C����CΪ
���B��D�Ľṹ��֪B����±������ˮ������C����CΪ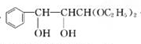 ��C������Ϣ�е�ˮ�ⷴӦ����D���Լױ�����ȩΪԭ���Ʊ�3-������ϩȩ
��C������Ϣ�е�ˮ�ⷴӦ����D���Լױ�����ȩΪԭ���Ʊ�3-������ϩȩ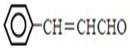 �������üױ�����������ȡ������һ�ȼױ�����ˮ�⡢�����ñ���ȩ���ñ���ȩ����ȩ������������Һ�з�Ӧ�ɵò�Ʒ���Դ˽����⣮
�������üױ�����������ȡ������һ�ȼױ�����ˮ�⡢�����ñ���ȩ���ñ���ȩ����ȩ������������Һ�з�Ӧ�ɵò�Ʒ���Դ˽����⣮
��� �⣺��1��3-������ϩȩ�����й����ŵ�����Ϊ̼̼˫����ȩ����
�ʴ�Ϊ��̼̼˫����ȩ����
��2�������Ϸ�����֪EΪ ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��3����Ӧ�Т�ȩ����Ӧ����Ӧ�����ֵõ�ȩ������������Ŀ���ǣ�����ȩ�����Է�����������
�ʴ�Ϊ������ȩ������������
��4����Ӧ��Ϊ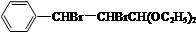 ��ˮ�ⷴӦ������ʽΪ
��ˮ�ⷴӦ������ʽΪ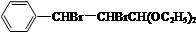 +2NaOH $��_{��}^{H_{2}O}$
+2NaOH $��_{��}^{H_{2}O}$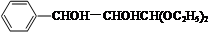 +2NaBr��
+2NaBr��
�ʴ�Ϊ��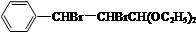 +2NaOH $��_{��}^{H_{2}O}$
+2NaOH $��_{��}^{H_{2}O}$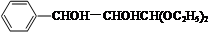 +2NaBr��
+2NaBr��
��5��DΪ ��HΪ
��HΪ ��D����������Ӧ����H�����Է�Ӧ�ݵĻ�ѧ����ʽΪ
��D����������Ӧ����H�����Է�Ӧ�ݵĻ�ѧ����ʽΪ +2Ag��NH3��2OH$\stackrel{��}{��}$
+2Ag��NH3��2OH$\stackrel{��}{��}$ +2Ag��+3NH3+H2O��
+2Ag��+3NH3+H2O��
�ʴ�Ϊ�� +2Ag��NH3��2OH$\stackrel{��}{��}$
+2Ag��NH3��2OH$\stackrel{��}{��}$ +2Ag��+3NH3+H2O��
+2Ag��+3NH3+H2O��
��6��DΪ ������������
������������
a���ȿɷ���������Ӧ�ֿɷ���ˮ��˵������ȩ����������
b������FeCl3��Һ������ɫ��Ӧ˵�����з��ǻ���
c���DZ��Ķ�ȡ����˵��������������ȡ������
�����������D��ͬ���칹��Ϊ����������-OH��-CH2CH2OOCH����-OH��-CH��CH3��OOCH�������ڼ�����֣����Թ���6�֣����к˴Ź���������6���˵������6����ԭ�ӵĽṹ��ʽΪ ��
�� ��
��
�ʴ�Ϊ��6�� ��
�� ��
��
��7���Լױ�����ȩΪԭ���Ʊ�3-������ϩȩ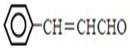 �������üױ�����������ȡ������һ�ȼױ�����ˮ�⡢�����ñ���ȩ���ñ���ȩ����ȩ������������Һ�з�Ӧ�ɵò�Ʒ���ϳ�·��Ϊ
�������üױ�����������ȡ������һ�ȼױ�����ˮ�⡢�����ñ���ȩ���ñ���ȩ����ȩ������������Һ�з�Ӧ�ɵò�Ʒ���ϳ�·��Ϊ ��
��
�ʴ�Ϊ�� ��
��
���� ���⿼���л����ƶ���ϳɣ�Ϊ�߿��������ͣ����ؿ���ѧ�������ƶ���������3-������ϩȩ��FΪͻ�ƿڲ��������ϵķ��������ƶϣ�ע���������Ϣ����Ӧ���������ƶϣ��ѵ���ͬ���칹�������жϣ��Ѷ��еȣ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ijѧ���ڿ�����ѧ����±�ء����Ȼ�ѧ֪ʶ����Ϊ�Լ���������һֻ��������Һ������������ʯī���ϸɵ���е�̿�������缫�������Ȼ�����Һ��Ϊ���Һ���Ƴ�����ͼ��ʾ��װ�ã�ͨ�������Ӻ����Ƶ�������Һ������ʵ���Ȼһ�ٻ�óɹ�����װ���е�Դ�缫�����ƺ�����Һ����Ҫ�ɷ���ȷ���ǣ�������
ijѧ���ڿ�����ѧ����±�ء����Ȼ�ѧ֪ʶ����Ϊ�Լ���������һֻ��������Һ������������ʯī���ϸɵ���е�̿�������缫�������Ȼ�����Һ��Ϊ���Һ���Ƴ�����ͼ��ʾ��װ�ã�ͨ�������Ӻ����Ƶ�������Һ������ʵ���Ȼһ�ٻ�óɹ�����װ���е�Դ�缫�����ƺ�����Һ����Ҫ�ɷ���ȷ���ǣ�������| A�� | aΪ������bΪ������NaClO��NaCl | B�� | aΪ������bΪ������NaClO��NaCl | ||
| C�� | a������b������HClO��NaCl | D�� | a������b������HClO��NaCl |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| ���ۼ� | ���� | ���ۼ� | ���� |
| H-H | 436 | H-F | 565 |
| C-F | 427 | H-S | 339 |
| C-C1 | 330 | H-Se | 314 |
| A�� | H2��g����2H��g����H=+436kJ/mol | |
| B�� | ����Խ�̣����ۼ�Խ�ι� | |
| C�� | ��ͬ������CH3F��CH3C1������ˮ�ⷴӦ | |
| D�� | ��ͬѹǿ�£�H2S�ķе��H2Se�ķе�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
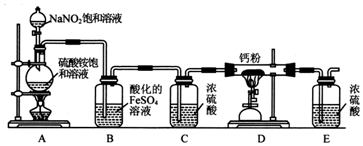
 ������װ�ú��װ�������Եķ����Ǽ��װ�������Եķ����ǣ��ر�A�з�Һ©���Ļ�������E�м�������ˮ����A�е�Բ����ƿ��E��������ð������ȴ��E�в������γ�һ��ˮ���������������ã�
������װ�ú��װ�������Եķ����Ǽ��װ�������Եķ����ǣ��ر�A�з�Һ©���Ļ�������E�м�������ˮ����A�е�Բ����ƿ��E��������ð������ȴ��E�в������γ�һ��ˮ���������������ã��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
��| ���� | ���볣����Ka�� |
| HCN | Ka=5��10-10 |
| H2CO3 | Ka1=4.5��10-7 Ka2=4.7��10-11 |
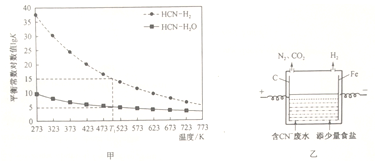
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| X | ��Alͬ���ڣ���������ǿ |
| Y | ��Alͬ���ڣ����������������ڲ��������3�� |
| Z | �����µ���Ϊ˫ԭ�ӷ��ӣ�Ϊ����ɫ�ж����� |
| W | �����Ϻ�ɫ����������Һ����ɫ |
 ��W��Ԫ�����ڱ��е�λ���ǵ������ڵڢ�A�壻
��W��Ԫ�����ڱ��е�λ���ǵ������ڵڢ�A�壻�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
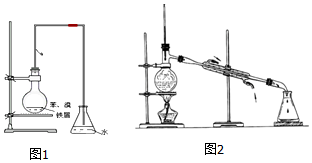 ��1��ijͬѧ�����ͼ1װ����ȡ�����屽��д��ʵ������ȡ�屽�Ļ�ѧ����ʽ
��1��ijͬѧ�����ͼ1װ����ȡ�����屽��д��ʵ������ȡ�屽�Ļ�ѧ����ʽ ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
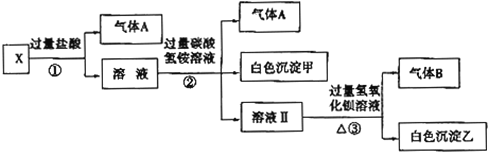
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ��Ӧʱ��/min | n��CO��/mol | n��H2O��/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A�� | ��Ӧ��t1min�ڵ�ƽ������Ϊv��H2��=0.40/t1 mol•L-1•min-1 | |
| B�� | ���������������䣬��ʼʱ�������г���0.60 molCO��1.20 molH2O������ƽ��ʱ��n��CO2��=0.40 mol | |
| C�� | ���������������䣬��ƽ����ϵ����ͨ��0.20 mol H2O��g������ԭƽ����ȣ��ﵽ��ƽ��ʱCOת��������H2O������������� | |
| D�� | �¶�����800�棬������Ӧƽ�ⳣ����Ϊ1.64��������ӦΪ���ȷ�Ӧ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com