
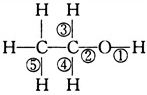
 ,关于乙醇在各种不同反应中断键的说法正确的是( )
,关于乙醇在各种不同反应中断键的说法正确的是( )| A. | 和金属钠反应键②断裂 | |
| B. | 在Cu催化下和O2反应键①④断裂 | |
| C. | 和浓硫酸共热140℃时,键①或键②断裂,170℃时键②⑤断裂 | |
| D. | 和氢溴酸反应键①断裂 |
 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:解答题
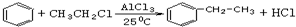
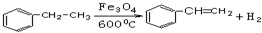 ;试以乙烯、苯、食盐、水等为原料制备苯乙醇 (
;试以乙烯、苯、食盐、水等为原料制备苯乙醇 (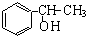 ),写出各步反应的化学方程式:
),写出各步反应的化学方程式: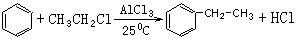 ;
;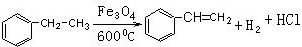 ;
;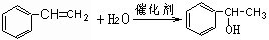 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把X和Y组成的合金放于潮湿的空气中,X先被腐蚀 | |
| B. | X原子最外层电子数比Y原子最外层电子数少 | |
| C. | X能从Y的盐溶液中把Y置换出来 | |
| D. | X的最高价氧化物的水化物碱性比Y的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
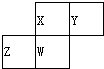 如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )
如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )| A. | 原子半径:Z>W>X>Y | |
| B. | 气态氢化物的稳定性:Z>W>X>Y | |
| C. | W的最高正化合价与负化合价的绝对值不可能相等 | |
| D. | Z的最高价氧化物的水化物可能为强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴苯中混有溴,加入KI溶液,振荡,用汽油萃取出I2 | |
| B. | 乙烷中混有乙烯,通过氢气在一定条件下反应,使乙烯转化为乙烷 | |
| C. | 乙烯中混有CO2和SO2,将其通过盛有NaOH溶液的洗气瓶,再干燥 | |
| D. | 除去乙醇中的微量水可加入金属钠,使其完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KNO3溶液 | B. | Na2SO4溶液 | C. | NaOH溶液 | D. | 稀HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
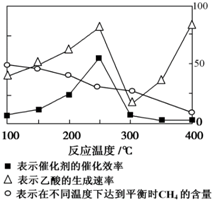 甲烷既是一种清洁能源,也是一种重要的化工原料.用催化剂可以将CO2和CH4直接转化成乙酸,反应方程式为:CO2(g)+CH4(g)?CH3COOH(g).
甲烷既是一种清洁能源,也是一种重要的化工原料.用催化剂可以将CO2和CH4直接转化成乙酸,反应方程式为:CO2(g)+CH4(g)?CH3COOH(g).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com