
| A. | 气体A为SO2和H2的混合物 | B. | 气体A中SO2与H2的体积比为5:1 | ||
| C. | 反应中共消耗Zn 97.5g | D. | 反应中共转移电子3mol |
分析 Zn和浓硫酸发生:Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O,随着反应的进行,溶液浓度减小,稀硫酸与Zn发生:Zn+H2SO4(稀)=ZnSO4+H2↑,则生成的气体为SO2和的H2混合物,根据反应的有关方程式结合质量守恒定律列方程组计算.
解答 解:生成气体的物质的量为:$\frac{33.6L}{22.4L/mol}$=1.5mol,溶液剩余硫酸的物质的量为$\frac{1}{2}$×1L×0.1mol/L=0.05mol,
参加反应的n(H2SO4)=0.1L×18.5mol/L-0.05mol=1.8mol,随着反应的进行,硫酸的浓度逐渐减小,
设反应生成xmolSO2,ymolH2,
Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O
x 2x x
Zn+H2SO4(稀)=ZnSO4+H2↑
y y y
$\left\{\begin{array}{l}{x+y=1.5}\\{2x=y=1.8}\end{array}\right.$
解得:$\left\{\begin{array}{l}{x=0.3}\\{y=1.2}\end{array}\right.$,
所以反应会生成0.3mol的二氧化硫和1.2mol的氢气.
A.由以上分析可知气体A为SO2和H2的混合物,故A正确;
B.气体A为SO2和H2的混合物,且V(SO2):V(H2)=1:4,故B错误;
C.反应中共消耗金属Zn的质量m(Zn)=(0.3mol+1.2mol)×65g/mol=97.5g,故C正确;
D.在反应Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O中,生成0.3mol的二氧化硫转移电子为0.6mol,反应Zn+H2SO4(稀)=ZnSO4+H2↑中,生成1.2mol氢气转移电子2.4mol,所以反应中共转移3mol电子,故D正确;
故选B.
点评 本题考查化学方程式的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,题目难度不大,注意浓硫酸和稀硫酸性质的不同,从质量守恒的角度解答该题,计算生成气体的物质的量关系是解答该题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
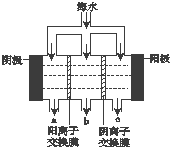 《科学》曾评出10大科技突破,其中“火星上‘找’到水的影子”名列第一.水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水质优劣直接影响人体健康.海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景.人类把海水淡化,就可以得到大量的饮用水,常规蒸馏法,技术和工艺比较完备,但也存在较大缺陷,大量推广离子交换法和电渗析法.
《科学》曾评出10大科技突破,其中“火星上‘找’到水的影子”名列第一.水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水质优劣直接影响人体健康.海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景.人类把海水淡化,就可以得到大量的饮用水,常规蒸馏法,技术和工艺比较完备,但也存在较大缺陷,大量推广离子交换法和电渗析法.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A B D C | B. | B A C D | ||
| C. | A B C D | D. | B A D C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质分子中一定存在共价键;最外层有2个电子的原子都是金属原子 | |
| B. | 非极性键可以存在于离子化合物中; 质子数相同的粒子不一定属于同种元素 | |
| C. | 同位素的化学性质几乎完全相同;任何原子的原子核都是由质子和中子构成的 | |
| D. | PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构; 伴有能量变化的物质变化都是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该元素位于元素周期表的第三周期ⅦA | |
| B. | 该元素位于元素周期表的第二周期VA | |
| C. | 该元素的常见化合价有:-1、0、+1、+3、+5、+7等 | |
| D. | 该元素的氢化物的稳定性比PH3、H2S弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加少量CH3COONa固体 | B. | 加水 | ||
| C. | 不用稀硫酸,改用98%浓硫酸 | D. | 用含有杂质铜的铁片 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaBr+2H2O.
+2NaBr+2H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com