
下列离子方程式书写正确的是
A.沸水中滴入FeCl3饱和溶液:Fe3++3H2O Fe(OH)3+3H+
Fe(OH)3+3H+
B.一小块钠投入水中:Na+2H2O=Na++2OH-+H2↑
C.用氢氧化钠溶液吸收过量二氧化碳 OH-+CO2=HCO3-
D.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3+ +2I- =2Fe2+ + I2
科目:高中化学 来源:2015届福建省、安溪第一中学高三9月摸底考试化学试卷(解析版) 题型:选择题
下列溶液中各微粒的浓度关系不正确的是
A.0.1 mol/L的HCOOH溶液中:c(HCOO—)+c(OH—)=c(H+)
B.1 L 0.1 mol/L的CuSO4·(NH4)2SO4·6H2O的溶液中: c(SO42—)>c(NH4+)>c(Cu2+)>c(H+)>c (OH—)
C.0.1 mol/L 的NaHCO3溶液中: c(Na+)+c(H+)=c(HCO3—)+2c(CO32—)+c(OH—)
D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:
c(Na+)>c(HX)>c(X—)>c(H+)>c(OH—)
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期半期考试化学试卷(解析版) 题型:选择题
将a g铁和氧化铁的混合物加入足量的盐酸中充分反应后,固体无剩余,测得参加反应的HCl为0.08 mol,放出标准状况下气体0.224 L.则下列判断中正确的是
A.原混合物中n(Fe)∶n(Fe2O3)=2∶1
B.向溶液中滴入KSCN溶液,显红色
C.无法计算原混合物的质量a
D.此时溶液中Fe2+和Fe3+的物质的量之比为3∶1
查看答案和解析>>
科目:高中化学 来源:2015届福建省四地六校高三上学期第一次月考化学试卷(解析版) 题型:填空题
(16分)亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
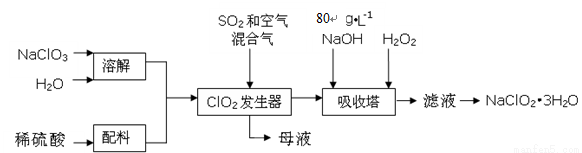
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2?3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
③80 g·L-1 NaOH溶液是指80 g NaOH固体溶于水所得溶液的体积为1L。
(1)80 g·L-1 NaOH溶液的物质的量浓度为 ;
(2)发生器中鼓入空气的作用可能是 (选填序号);
a.将SO2氧化成SO3,增强酸性 b.将NaClO3氧化成ClO2 c.稀释ClO2以防止爆炸
(3)从“母液”中可回收的主要物质是 ;
(4)吸收塔内的反应的化学方程式为 ;
吸收塔的温度不能超过20℃,其目的是 ;
(5)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是 ;
(6)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是 (选填序号);
a.Na2S b.Na2O2 c.FeCl2
(7) 从吸收塔出来的溶液中得到NaClO2?3H2O粗晶体的实验操作依次是 (选填序号)。
a.蒸发浓缩 b.蒸馏 c.过滤 d.灼烧 e.冷却结晶
查看答案和解析>>
科目:高中化学 来源:2015届福建省四地六校高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列实验操作中,错误的是
A.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
B.用100 mL容量瓶配制90mL1mol/L的NaOH溶液
C.用pH试纸测得新制氯水的pH为2
D.用酸式滴定管准确量取10.00mLKMnO4溶液
查看答案和解析>>
科目:高中化学 来源:2015届福建省四地六校高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列有关物质分类或归类正确的一组是
① 酸性氧化物:SO2、NO、CO2、SiO2
② 氢氟酸、盐酸、水玻璃、氨水均为混合物
③ 明矾、小苏打、硫酸钡、HClO均为电解质
④ 碘酒、牛奶、豆浆、漂粉精均为胶体
⑤ 液氨、液氯、干冰、碘化银均为化合物
A.①和 ③ B.②和③ C.③和④ D.②和⑤
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中化学试卷(解析版) 题型:选择题
一定温度下,硫酸铜受热分解生成CuO、SO2、SO3和O2。已知:SO2、SO 3都能被碱石灰和氢氧化钠溶液吸收。用下图装置加热硫酸铜粉末直至完全分解。若硫酸铜粉末质量为10.0 g,完全分解后,各装置的质量变化关系如下表所示。

装置 | A(试管+粉末) | B | C |
反应前 | 42.0 g | 75.0 g | 140.0 g |
反应后 | 37.0 g | 79.5 g | 140.0 g |
请通过计算,推断出该实验条件下硫酸铜分解的化学方程式是
A.4CuSO4 4CuO+2SO3↑+2SO2↑+O2↑
4CuO+2SO3↑+2SO2↑+O2↑
B.3CuSO4 3CuO+SO3↑+2SO2↑+O2↑
3CuO+SO3↑+2SO2↑+O2↑
C.5CuSO4 5CuO+SO3↑+4SO2↑+2O2↑
5CuO+SO3↑+4SO2↑+2O2↑
D.6CuSO4 6CuO+4SO3↑+2SO2↑+O2↑
6CuO+4SO3↑+2SO2↑+O2↑
查看答案和解析>>
科目:高中化学 来源:2015届福建省高二上学期半期联考化学试卷(解析版) 题型:实验题
(14分)某实验小组用0.50mol/L氢氧化钠溶液和0.50mol/L硫酸溶液进行反应热的测定。
Ⅰ.配制0.50mol/L氢氧化钠溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体_________克。
(2)配制过程中,所需要的玻璃仪器有_____________________________________
Ⅱ.测定稀硫酸和稀氢氧化钠溶液反应的反应热实验装置如下:
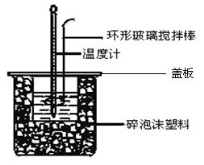
(3)如图装置中仪器环形玻璃搅拌棒作用是___________________________________;
(4)烧杯间填满碎泡沫塑料、大烧杯上加盖硬纸板的作用是__________________
(5)已知稀硫酸与稀氢氧化钠溶液发生中和反应生成1 mol水时,放出57.3 KJ热量。请写出硫酸与氢氧化钠发生中和反应的热化学方程式:__________________________________________,用0.2 mol 稀硫酸溶液与足量稀氢氧化钠溶液反应,能放出________kJ热量。
(6)在测定中和反应的反应热的实验中,下列叙述正确的是
A.测定中和反应的反应热时,酸碱中和之后应读取体系达到的最高温度
B.中和反应的试验中,应快速将NaOH溶液一次倒入盛盐酸的小烧杯中
C.可以用氢氧化钾代替氢氧化钠,浓硫酸代替稀硫酸
D.在测定中和反应的反应热实验中,每完成一次反应热热测定,至少需要读三次温度
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期半期联考化学试卷(解析版) 题型:选择题
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:
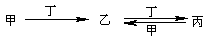
下列有关物质的推断不正确的是
A.若甲为焦炭,则丁可能是O2
B.若甲为氮气,则丁可能是O2
C.若甲为Fe,则丁可能是稀硝酸
D.若甲为NaOH溶液,则丁可能是CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com