
| A. | NaH在水中显碱性 | |
| B. | NaH中氢离子电子层排布与氦原子相同 | |
| C. | NaH中氢离子半径比锂离子半径大 | |
| D. | NaH中氢离子被还原为H2 |
分析 氢化钠中含有钠离子和氢离子,为离子晶体,氢化钠和水反应生成氢气,反应方程式为:NaH+H2O=NaOH+H2↑,该反应中氢元素化合价由-1价、+1价变为0价,据此分析解答.
解答 解:A.氢化钠与水反应生成氢氧化钠和氢气,氢氧化钠为强碱,溶液显碱性,故A正确;
B.NaH中H元素是-1价,其核外电子数为2,所以其电子层排布与氦原子的相同,故B正确;
C.氢化钠中氢离子和锂离子电子层结构相同,相同电子层结构的离子其离子半径随着原子序数的增大而减小,所以氢离子半径大于锂离子,故C正确;
D.氢化钠中氢元素的化合价由-1价变为0价,氢离子失电子被氧化生成氢气,故D错误;
故选:D.
点评 本题考查氢化钠的性质及结构,题目难度不大,侧重考查氧化还原反应,准确判断元素的化合价,根据化合价的变化分析氧化还原反应即可解答.


科目:高中化学 来源: 题型:选择题
| A. | 2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | B. | I2+SO2+2H2O═H2SO4+2HI | ||
| C. | H2O2+H2SO4═SO2+O2↑+H2O | D. | 2Fe3++2I-═2Fe2++I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 消耗氧气的体积为1.68 L | |
| B. | 混合气体中含NO21.12 L | |
| C. | 此反应过程中转移的电子为0.3 mol | |
| D. | 参加反应的硝酸是0.4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 150 | 300 | 380 | 410 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乙烯塑料的老化是因为发生了加成反应 | |
| B. | 水晶项链和餐桌上的瓷盘都是硅酸盐制品 | |
| C. | 棉花和木材的主要成分都是纤维素,蚕丝和人造丝的主要成分都是蛋白质 | |
| D. | 在清洗地板时,84消毒液和洁厕灵(主要成分是盐酸)不能混合使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 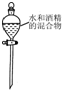 分离水和酒精 | |
| B. |  蒸发NH4Cl溶液得到NH4Cl晶体 | |
| C. | 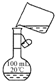 配制一定物质的量浓度溶液时转移溶液 | |
| D. |  除去氯气中的氯化氢 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com