
【题目】下列各组物质,按化合物、单质、混合物顺序排列的是( )
A.烧碱、液态氧、碘酒
B.生石灰、白磷、熟石灰
C.干冰、铁、氯化氢
D.空气、氮气、胆矾
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:
【题目】
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是 ______。
A.C(s)+H2O(g)═CO(g)+H2(g)△H>0
B.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H<0
C.2H2(g)+O2(g)═2H2O(l)△H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极的电极反应式为 。
(3)电解原理在化学工业中有着广泛的应用.现将你设计的原电池通过导线与图中电解池相连,其中a为电解液,X和Y均为惰性电极,则: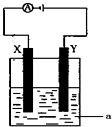
①若a为CuSO4溶液,则电解时的化学反应方程式为 .通电一段时间后,向所得溶液中加入0.2molCuO粉末,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷精矿粉酸浸时发生反应:2Ca5(PO4)3(OH)+3H2O+10H2SO4![]() 10CaSO4·0.5H2O+6H3PO4。有关说法正确的是( )
10CaSO4·0.5H2O+6H3PO4。有关说法正确的是( )
A. 该反应属于氧化还原反应
B. 硫酸酸性比磷酸强
C. Ca5(PO4)3(OH)是牙釉质的主要成分,易溶于水
D. S、P同主族,S的非金属性更强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为2L的密闭容器中发生2SO2+O22SO3反应,现控制下列三种不同的条件:①在400℃时,10molSO2与5molO2反应;
②在400℃时,20molSO2与5molO2反应;
③在300℃时,10molSO2与5molO2反应;
(1)开始时,化学反应速率快慢顺序是;
(2)若10min内测得第①组的平均反应速率为:V(SO2)=0.4mol/(Lmin),则V(O2)= , 10min时,SO3浓度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,既属于氧化还原反应又属于吸热反应的是
A. Ba(0H)28H20与NH4Cl反应 B. 工业合成氨
C. 灼热的炭与CO2反应 D. 葡荀糖在人体内生理氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式书写正确的是(△H的绝对值均正确)( )
A.C(s)+ ![]() O2(g)═CO(g)△H=﹣110.5KJmol﹣1(燃烧热)
O2(g)═CO(g)△H=﹣110.5KJmol﹣1(燃烧热)
B.C2H5OH+3O2═2CO2+3H2O△H=﹣1368.8KJmol﹣1(反应热)
C.2NaOH(aq)+H2SO4(aq)═Na2SO4(aq)+2H2O (l)△H=﹣114.6KJmol﹣1(中和热)
D.2H2O(g)═2H2(g)+O2(g)△H=+483.6KJmol﹣1(反应热)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家合成了一种新型药剂(G),它被杂草吸收后能在其体内传导,甚至到达根部,从而使杂草彻底死亡。其合成路线如下:
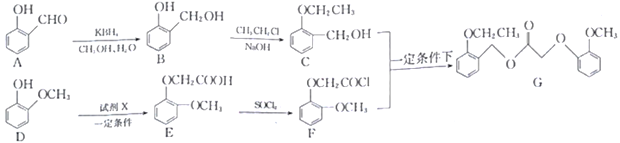
(1)中间体E中含氧官能团的名称_________________。
(2)A→B反应类型是_______________________。
(3)已知D→E转化的另一产物是HBr,则试剂X的结构简式为_________________。
(4)写出C+F→G的化学方程式:__________________________________。
(5)写出同时满足下列条件的E的同分异构体的结构简式________________ (写出一种即可)。
①属于芳香族化合物;
②磁共振氢谱有四组峰,峰面积比为1∶1∶2∶6;
③能发生银镜反应,水解产物之一能和FeCl3溶液发生显色反应。
(6)化合物H(H2NCH2CH2![]() OCH3)是合成利托君的重要中间体,写出以对-甲基苯酚和 CH3Br 为主要原料合成化合物H的路线:_____________________________________________(其他无机试剂任选)。
OCH3)是合成利托君的重要中间体,写出以对-甲基苯酚和 CH3Br 为主要原料合成化合物H的路线:_____________________________________________(其他无机试剂任选)。
提示:R—Cl![]() R—CN
R—CN![]() RCH2NH2
RCH2NH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化铝、磷化锌、磷化钙与水反应产生高毒的PH3气体(熔点为-132℃,还原性强、易自燃),可用于粮食熏蒸杀虫。卫生安全标准规定:当粮食中磷化物(以PH3计)的含量低于0.05mg·kg-1时算合格。可用以下方法测定粮食中残留的磷化物含量:
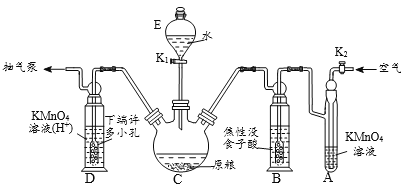
【操作流程】安装吸收装置→PH3的产生与吸收→转移KMnO4吸收溶液→亚硫酸钠标准溶液滴定。
【实验装置】C中盛100 g原粮,D中盛有 20.00 mL 1.12×10-4 mol L-1KMnO4溶(H2SO4酸化)。
请回答下列问题:
(1)仪器C的名称是_________;原粮最好先打成粉末,其原因是_____________。
(2)磷化钙与水反应有化学方程式为_____________________________________;检查整套装置气密性良好的方法是_______________________________________。
(3)A中盛装KMnO4溶液的作用是除去空气中的还原性气体;B中盛装焦性没食子酸的碱性溶液,其作用是吸收空气中的O2,防止___________;通入空气的作用是____________。
(4)D中PH3被氧化成磷酸,所发生反应的离子方程式为_________________________。
(5)把D中吸收液转移至容量瓶中,加水稀释至250mL,取25.00mL于锥形瓶中,用5.0×10-5mol L-1的Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗标Na2SO3准溶液11.00mL,则该原粮中磷化物(以PH3计)的含量为______mg kg-1,该原粮质量________(填“合格”或“不合格”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pKa=lgKa,25℃时,H2A 的 pKa1=1.85,pKa2=7.19。常温下,用 0.1 mol/LNaOH 溶液滴定 20 mL 0.1 mol/LH2A 溶液的滴定曲线如图所示。下列说法正确的是( )
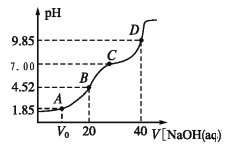
A. A 点所得溶液中:V0<10 mL
B. B 点所得溶液中:c(H2A)+c(H+)=c(HA-)+c(OH-)
C. C 点所得溶液中:c(A2-)= c(Na+)—c(HA-)—c(H2A)
D. D 点所得溶液中 A2-水解平衡常数 Kh1=107.19
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com