
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42﹣可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.下列叙述正确的是( ) 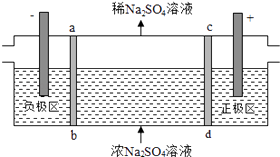
A.通电后中间隔室的SO42﹣离子向正极迁移,正极区溶液pH增大
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C.负极反应为2H2O﹣4e﹣=O2+4H+ , 负极区溶液pH降低
D.当电路中通过1mol电子的电量时,会有0.5mol的O2生成
【答案】B
【解析】解:A、阴离子向阳极(即正极区)移动,氢氧根离子放电pH减小,故A错误;
B、直流电场的作用下,两膜中间的Na+和SO42﹣可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室,通电时,氢氧根离子在阳极区放电生成水和氧气,考虑电荷守恒,两膜中间的硫酸根离子会进入正极区,与氢离子结合成硫酸;氢离子在阴极得电子生成氢气,考虑电荷守恒,两膜中间的钠离子会进入负极区,与氢氧根离子结合成氢氧化钠,故可以得到NaOH和H2SO4产品,故B正确;
C、负极即为阴极,发生还原反应,氢离子得电子生成氢气,故C错误;
D、每生成1mol氧气转移4mol电子,当电路中通过1mol电子的电量时,会有0.25mol的O2生成,故D错误.
故选B.
A、阴离子向阳极(即正极区)移动,氢氧根离子放电pH减小;
B、从两极的电极反应和溶液的电中性角度考虑;
C、负极即为阴极,发生还原反应,氢离子放电;
D、当电路中通过1mol电子的电量时,会有0.25mol的O2生成.


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案科目:高中化学 来源: 题型:
【题目】等量的苛性钠溶液分别用pH值为2和3的醋酸溶液中和,设消耗醋酸溶液的体积依次为Va和Vb , 则它们之间的关系是( )
A.Va>10Vb
B.Vb=10Va
C.Va<10Vb
D.Vb>10Va
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示各物质之间的转化关系.已知:常温下D、E、F、I、J为气体,且D、I是水煤气的主要成分;B是无色液体,M为红褐色固体,C的焰色反应为黄色. 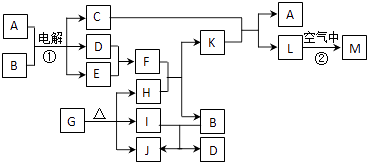
(1)基于反应①原理的化学工业称为 , 写出该反应的化学方程式 .
(2)写出K和E反应的离子方程式 . 写出F溶液和H反应的离子方程式 .
(3)已知:由G分解得到的H、I、J三者的物质的量之比为1:1:1,则G的化学式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.在常温常压下,11.2L氮气所含的原子数目为NA
B.1.7g氨气所含分子数目为0.1NA
C.1L 1molL﹣1的Na2SO4溶液中含有Na+的个数为NA
D.2g氢气所含氢原子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有药品和如图装置:质量为wg的锌片、稀H2SO4、无水硫酸铜和蒸馏水, 设计一个简单的实验,测定Zn的相对原子质量(气体体积均可认为是在标准状况下测定)参见如图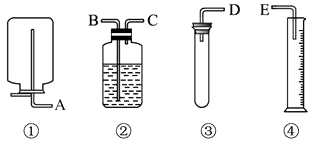
(1)应选用的装置的连接顺序是(填接口字母) .
(2)操作中,怎样加放试剂以保证不漏出氢气 .
(3)以下是测量收集气体体积必须包括的几个步骤,则这三步操作的正确顺序是 ①调整量筒内外液面调试使之相同
②使试管和量筒内气体都冷却至室温
③读取量筒内气体的体积.
(4)若④中收集到水VmL(锌片反应完全),则锌的相对原子质量的数学表达式为 .
(5)由于锌片可能含不溶性杂质,实验测得的锌的相对原子质量可能比真实值(填“偏高”或“偏低”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的金属Na、Mg、Al分别与100mL 2molL﹣1的盐酸反应,实验测得生成气体的体积V(已折合为标准状况)与时间t的关系如图所示,则下列说法错误的是( ) 
A.x=2.24
B.钠的物质的量为0.2 mol
C.反应时,Na、Mg、Al均过量
D.曲线b为Mg与盐酸反应的图象
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com