
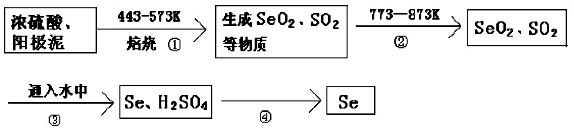
分析 在电解铜的阳极泥中含有 3-14% Se元素,由提纯流程可知,焙烧时S、Se反应转化为SO2、SeO2,二者性质相似,均为分子晶体,加热至773K时为气态,流程②的目的是使SO2、SeO2挥发出来,再加水发生H2SeO3+2SO2+H2O═Se+2SO42-+4H+,Se不溶于水,则流程④为过滤操作,过滤可得到Se,以此来(1)、(2)、(3);
(4)利用题中信息可知Se与浓HNO3反应,Se被氧化为+4价的H2SeO3,HNO3还原为NO与NO2,利用电子守恒和限定条件(生成NO与NO2的物质的量之比为1:1,即二者计量系数比为1:1)可得方程式,结合两种还原产物分析.
解答 解:(1)由上述分析可知,流程②的目 的是使SO2、SeO2挥发出来,由反应可知,硫酸在①中消耗,在③中生成,则硫酸可循环利用,
故答案为:使SO2、SeO2挥发出来; 硫酸;
(2)H2SeO3与SO2的离子反应方程式为H2SeO3+2SO2+H2O═Se+2SO42-+4H+,
故答案为:H2SeO3+2SO2+H2O═Se+2SO42-+4H+;
(3)由Se+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$SeO2↑+2SO2↑+2H2O、H2SeO3+2SO2+H2O═Se+2SO42-+4H+可知,氧化剂的氧化性大于氧化产物的氧化性,则氧化性为H2SO4(浓)>SeO2>SO2,故答案为:H2SO4(浓)>SeO2>SO2;
(4)利用题中信息可知Se与浓HNO3反应,Se被氧化为+4价的H2SeO3,HNO3还原为NO与NO2,生成NO与NO2的物质的量之比为1:1,即二者计量系数比为1:1,令二者系数为1,根据电子转移守恒可知,Se的系数为$\frac{1×3+1×1}{4}$=1,故反应方程式为Se+2HNO3(浓)=H2O+SeO2+NO↑+NO2↑,如不对该反应还原产物的比例作限制,该反应可能出现多组配平系数,是因该反应有两种还原产物,两者的比例和还原剂的用量都可以发生改变;
故答案为:Se+2HNO3(浓)=H2O+SeO2+NO↑+NO2↑;可能.
点评 本题考查混合物分离提纯的综合应用,为高频考点,把握流程及发生的反应、混合物分离方法等为解答的关键,侧重分析、计算能力的考查,(4)为解答的难点,题目难度中等.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:选择题
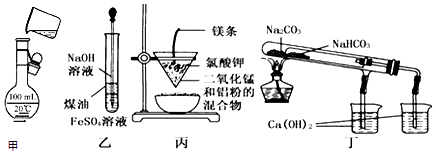
| A. | 用甲图所示装置将溶液定容到100 mL | |
| B. | 用乙图装置制备Fe(OH)2 | |
| C. | 用丙图装置可制得金属锰 | |
| D. | 用丁图装置验证NaHCO3和Na2CO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
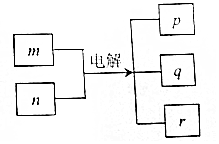 短周期元素W、X、Y、Z的原子序数依次增加.m、n、r是由这些元素组成的化合物,p、q分别是元素W、Z的气体单质.r溶液是实验室中常见试剂,常温下0.1mol•L-1r溶液的pH为13,工业上制备r和q的反应如图所示,下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.m、n、r是由这些元素组成的化合物,p、q分别是元素W、Z的气体单质.r溶液是实验室中常见试剂,常温下0.1mol•L-1r溶液的pH为13,工业上制备r和q的反应如图所示,下列说法正确的是( )| A. | 单质的沸点:W>X | |
| B. | 简单离子半径:Z>Y>X | |
| C. | W与其他3种元素均能形成共价化合物 | |
| D. | X与其他3种元素均可形成至少两种二元化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
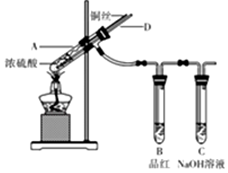 某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验,实验装置如图所示:
某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验,实验装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Cu2+、SO42-、Cl- | B. | Ca2+、Na+、CO32-、NO3- | ||
| C. | Na+、K+、Cl-、MnO4- | D. | Na+、Ba2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com