
【题目】下列选项正确的是( )
A.汽车催化转化器中尾气处理反应的化学方程式为CO+NO ![]() C+NO2
C+NO2
B.铁红溶于足量氢碘酸的离子方程式为Fe2O3+6H+═2Fe3++3H2O
C.加入铝粉能产生氢气的溶液中可能存在大量的:K+、Ba2+、AlO2﹣、Cl﹣
D.pH=0的溶液中可能存在大量的:Na+、Fe2+、SO42﹣、ClO﹣
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】工业上,可以由下列反应合成三聚氰胺: CaO+3C ![]() CaC2+CO↑;CaC2+N2
CaC2+CO↑;CaC2+N2 ![]() CaCN2+C;CaCN2+2H2O=NH2CN+Ca(OH)2 , NH2CN与水反应生成尿素[CO(NH2)2],再由尿素合成三聚氰胺.
CaCN2+C;CaCN2+2H2O=NH2CN+Ca(OH)2 , NH2CN与水反应生成尿素[CO(NH2)2],再由尿素合成三聚氰胺.
(1)写出与Ca在同一周期的Cr原子的外围电子排布式 .
(2)写出CaC2中阴离子C22﹣的一种等电子体的化学式 .
(3)1mol 尿素分子[CO(NH2)2]中含有的π键与σ键的数目之比为 .
(4)三聚氰胺俗称“蛋白精”,其结构为  .其中氮原子的杂化方式有 .
.其中氮原子的杂化方式有 .
(5)CaO晶胞如图所示,CaO晶体中与O2﹣距离最近的Ca2+的个数为 . CaO晶体的熔点比NaCl晶体的熔点高的主要原因是 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O35H2O)俗名“大苏打”,又称“海波”.已知Na2S2O35H2O是无色透明晶体,易溶于水,不溶于乙醇.它受热、遇酸易分解,在空气中易被氧化.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O35H2O).反应原理为2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2 . 
(1)(图1)制备Na2S2O3
①仪器b的名称 , d中盛放的试剂是 .
②b中制备SO2 , 反应的化学方程式 .
③反应开始后,要控制SO2生成速率,可以采取的措施有(写出一条即可).
(2)分离Na2S2O3并测定含量(图2)
(I)为了减少产品损失,操作①时需 . 操作②是过滤、洗涤、干燥,其中洗涤操作时用做洗涤剂.干燥操作时(装置如图3所示),通入H2的目的是 .
(II)制得的粗晶体中往往含有少量杂质.为了测定粗产品中Na2S2O35H2O的含量,采用在酸性条件下用KMnO4标准液滴定的方法(假设粗产品中的杂质与酸性KMnO4溶液不反应).称取1.50g粗产品溶于水,用0.20molL﹣1KMnO4溶液(加适量稀硫酸酸化)滴定,当溶液中S2O32﹣全部被氧化时,消耗高锰酸钾溶液体积40.00mL.(5S2O32﹣+8MnO4﹣+14H+═8Mn2++10SO42﹣+7H2O)
①KMnO4溶液置于(填“酸式”或“碱式”)滴定管中.
②若 , 则达到滴定终点.
③产品中Na2S2O35H2O的质量分数为(保留小数点后一位).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C、I和气体甲、乙、丙及物质D、E、F、G、H.其中B是地壳中含量最多的金属元素.它们之间能发生如下反应(图中部分反应产物和反应条件没有全部标出). 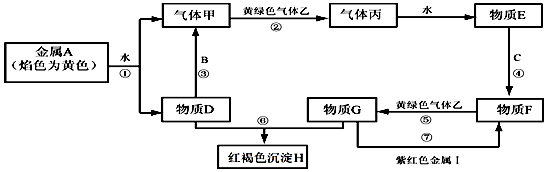
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:H、I;
(2)写出反应③的化学方程式:; 写出反应⑤的离子方程式:;写出反应⑦的离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意填空
(1)根据分子中所含官能团可预测有机化合物的性质. ①下列化合物中能发生消去反应的是(填字母).
a.CH3OH b.CH3CH2Cl c.CH3CH2OH d. 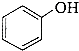
②下列化合物中,常温下易被空气氧化的是(填字母).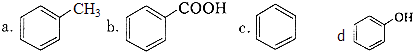
(2)甲苯( ![]() )是一种重要的有机化工原料. ①甲苯分子中一定共平面的碳原子有个.
)是一种重要的有机化工原料. ①甲苯分子中一定共平面的碳原子有个.
②甲苯苯环上的一溴代物有种,请写出其中一种的结构简式 .
③除去苯中混有的少量甲苯,可选用的试剂是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是( )
A.2H2(g)+O2(g)═2H2O(1)△H=﹣285.8kJ/mol
B.2H2(g)+O2(g)═2H2O(1)△H=+571.6kJ/mol
C.2H2(g)+O2(g)═2H2O(g)△H=﹣571.6kJ/mol
D.H2(g)+ ![]() O2(g)═H2O(1)△H=﹣285.8kJ/mol
O2(g)═H2O(1)△H=﹣285.8kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用高岭土(主要成分为A12 O3、SiO2和Fe2O3)为原料制备水质净化剂PAC{[A12(OH)nC16﹣n]m(n<6,m为聚合度)}的过程如图.下列说法正确的是( ) 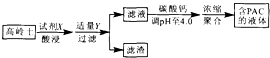
A.试剂X为H2SO4
B.滤渣主要成分为Fe(OH)3、H2 SiO3
C.调pH过高或过低均会减少PAC生成
D.滤液浓缩聚合过程发生了加聚反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com