
下列说法正确的是()
A. 升高温度能使化学反应速率增大,主要原因是增加了反应物分子 中活化分子的百分数
中活化分子的百分数
B. 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C. 增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大
D. 催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率
考点: 化学反应速率的影响因素.
专题: 化学反应速率专题.
分析: 温度、催化剂可影响活化分子的百分数,而浓度、压强只改变单位体积活化分子的数目,不改变百分数,另外,催化剂可降低反应的活化能.
解答: 解:A.升高温度,可增加反应物分子中活化分子的百分数,使反应速率增大,故A正确;
B.增大压强,可增大单位体积的活化分子数目,但百分数不变,故B错误;
C.增大反应物浓度,可增大单位体积内活化分子的数目,但百分数不变,故C错误;
D.加入催化剂,降低反应物的活化能,增大活化分子的百分数,反应速率增大,故D错误.
故选A.
点评: 本题考查化学反应速率的影响因素,侧重于学生的分析能力和基本概念的理解和运用的考查,为高频考点,注意外界条件下对反应速率的影响,难度不大.


科目:高中化学 来源: 题型:
海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程.

下列有关说法正确的是()
A. 制取NaHCO3的反应是利用其溶解度小于NaCl
B. 用澄清的石灰水可鉴别NaHCO3和Na2CO3
C. 在工段③、④、⑤中,溴元素均被氧化
D. 工业上通过电解饱和MgCl2溶液制取金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
已知NaHC2O4溶液显弱酸性,向100mL0.1mol•L﹣1的NaHC2O4.溶液中分别加入下列物质,有关说法正确的是()
A. 加入少量H2 C2O4固体,促进水电离,溶液中c(H+)增大
B. 加入NaOH溶液至恰好完全反应,则溶液中:c(Na+)>c(C2O42﹣)>c(HC2O4﹣)>c(H+)
C. 加入氨水至中性,则溶液中:c(NH4+)+c(Na+)=2c(C2O42﹣)+c(HC2O4﹣)
D. 加入0.01 mol Na2C2O4固体,则溶液中:3c(Na+)=2
查看答案和解析>>
科目:高中化学 来源: 题型:
在一个容积为2L的密闭容器中,发生如下反应:3X(气)+Y(气)═2Z(气),若最初加入的X、Y和Z都是1mol,反应中X的平均反应速率为0.12mol•L﹣1•s﹣1.若要产物Z为1.8mol,反应所需的时间为()
A. 5s B. 10s C. 15s D. 20s
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组热化学方程式中,化学反应的△H前者 大于后者的是()
大于后者的是()
①C(s)+O2(g)═CO2(g);△H1 C(s)+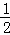 O2(g)═CO(g);△H2
O2(g)═CO(g);△H2
②S(s)+O2(g)═SO2(g);△H3 S(g)+O2(g)═SO2(g);△H4
③H2(g)+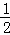 O2(g)═H2O(l);△H5 2H2(g)+O2(g)═2H2O(l);△H6
O2(g)═H2O(l);△H5 2H2(g)+O2(g)═2H2O(l);△H6
④CaCO3(s)═CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)═Ca(OH)2(s);△H8.
A. ① B. ④ C. ②③④ D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
用H2O2和H2SO4的混合溶液可溶出废旧印刷电路板上的铜.已知:Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H1=+64.39kJ/mol2H2O2(l)═2H2O(l)+O2(g)△H2=﹣196.46kJ/molH2(g)+ O2(g)═H2O(l)△H3=﹣285.84kJ/mol求在H2SO4溶液中,Cu与H2O2反应生成Cu2+(aq)和H2O(l)的反应热为多少?
O2(g)═H2O(l)△H3=﹣285.84kJ/mol求在H2SO4溶液中,Cu与H2O2反应生成Cu2+(aq)和H2O(l)的反应热为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
根据以下3个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=﹣Q1 kJ/mol
2H2S(g)+O2(g)=2S(s)+2H2O(l)△H=﹣Q2 kJ/mol
2H2S(g)+O2(g)=2S(s)+2H2O(g)△H=﹣Q3 kJ/mol
判断Q1、Q2、Q3三者关系正确的是()
A. Q1>Q2>Q3 B. Q1>Q3>Q2 C. Q3>Q2>Q1 D. Q2>Q1>Q3
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家利用太阳能分解水生成的氢气在催化剂作用下与CO2反应生成甲醇(CH3OH),并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为﹣285.8kJ/mol、﹣283.0kJ/mol和﹣726.5kJ/mol,请回答下列问题:
(1)用太阳能分解5mol水消耗的能量是 kJ.
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 .
(3)已知25℃、101kPa下,H2O(l)═H2O(g)△H=+44kJ•mol﹣1.则1g甲醇(CH3OH)燃烧 生成CO2和气态水时放出的热量为 .
生成CO2和气态水时放出的热量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应aA(g)+bB(g)⇌cC(g)+dD(g)符合图.则下列叙述正确的是()

A. a+b<c+d;正反应吸热 B. a+b>c+d;正反应放热
C. a+b<c+d;正反应放热 D. a+b>c+d;正反应吸热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com