
����Ŀ�����ֶ�����Ԫ��X��Y��Z��W��ԭ�����������������ϱ�����Ϣ�ش��������⣮
X | Y | Z | W | |
�ṹ | X������������Ӧ��ˮ����������̬�⻯�ﷴӦ�ɵõ�һ���� | ��ɫ��Ӧ�ʻ�ɫ | ��ͬ��������Ԫ���γɵļ������У�Z�����Ӱ뾶��С | ԭ�Ӻ��������������Ǵ�����������һ�� |
��1��д��X���ʵĵ���ʽ ��
��2��WԪ�������ڱ��е�λ��Ϊ ��
��3��Y������������Ӧˮ������Z���ʷ�Ӧ�Ļ�ѧ����ʽ ��
��4�����п���Ϊ�Ƚ�Z��Mg������ǿ���ķ�����������ţ���
a���Ƚ�����Ԫ���ڻ������л��ϼ۵ĸߵ�
b����ͬ�¶��²��Ũ����Ӧ�Ȼ���ˮ��Һ��pH
c���ڳ��������±Ƚϵ�����Ũ���ᷴӦ�ľ��ҳ̶�
d�������ֽ����Ȼ����ˮ��Һ�зֱ�μӹ�����NaOH��Һ
e���Ƚϵ��������ֽ��������ᷴӦ������Ķ��٣�
���𰸡�
��1��![]()
��2���������ڢ�A��
��3��2Al+2NaOH+2H2O=2NaAlO2+3H2��
��4��bd
���������⣺���ֶ�����Ԫ��X��Y��Z��W��ԭ��������������X������������Ӧ��ˮ����������̬�⻯�ﷴӦ�ɵõ�һ���Σ���XΪNԪ�أ�Y��ɫ��Ӧ�ʻ�ɫ����YΪNa��Z��Wԭ����������Na�����ߴ��ڵ������ڣ���ͬ��������Ԫ���γɵļ������У�Z�����Ӱ뾶��С����ZΪAl��Wԭ�Ӻ��������������Ǵ�����������һ�룬����������Ϊ4����WΪSiԪ��.
��1.��XΪNԪ�أ��䵥��Ϊ���������������к��е��������������ĵ���ʽΪ ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ��
��
��2.��WΪSiԪ�أ���ԭ������Ϊ14���������ڱ��е������ڢ�A�壬���Դ��ǣ��������ڢ�A�壻
��3.��Y������������Ӧˮ����ΪNaOH��Z����ΪAl����������������Һ��Ӧ����ƫ�����ƺ���������Ӧ�Ļ�ѧ����ʽΪ2Al+2NaOH+2H2O=2NaAlO2+3H2����
���Դ��ǣ�2Al+2NaOH+2H2O=2NaAlO2+3H2����
��4.��a��������ǿ���뻯�ϼ۸ߵ��أ�����ʧȥ�����������أ��������׳̶��йأ���a����
b���Ȼ���ˮ��Һ������Խǿ�������Ԫ�ص�����������Ӧˮ����ļ���Խ����������Խ������b��ȷ��
c������Al��Ũ�����з����ۻ������ܱȽϽ�����ǿ������c����
d��������þ�������������Ʒ�Ӧ�����������������������Ʒ�Ӧ��˵��������������һ�������ԣ���������þ�ļ��Ը�ǿ�����ԱȽ���Ԫ�صĽ����ԣ���d��ȷ��
e�����������ֽ��������ᷴӦ������Ķ����������ǿ���أ���e����
���Դ��ǣ�bd��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йذ���ӵ�����(NA)��˵���������
A��32��O2������ԭ����ĿΪNA
B��0.5 mol H2O���е�ԭ����ĿΪ1.5NA
C��1 mol H2O���е�H2O������ĿΪNA
D��0.5 NA���������ӵ����ʵ�����0.5 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ƭ�����ᷴӦ��H2�����ʽ��������д�ʩ�����ӿ췴Ӧ���ʵ���
A. �����۴�����ƬB. ���������Ũ��
C. ����ͬŨ�ȴ����������D. �ʵ�������Һ�¶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ΪN��R2�����ӣ�������ΪA����n g�������������������ӵ����ʵ�����(����)
A.![]() (A��N��8) mol
(A��N��8) mol
B.![]() (A��N��10) mol
(A��N��10) mol
C.(A��N��2) mol
D.![]() (A��N��6) mol
(A��N��6) mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ijһ��������ɱ���ܱ������з������·�Ӧ��A��g��+B��g��2C��g����H��0��t1ʱ�̴ﵽƽ�����t2ʱ�̸ı�ijһ�������䷴Ӧ������ͼ������˵����ȷ���ǣ������� 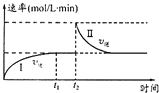
A.0��t2ʱ��v����v��
B.�������̴ﵽƽ��ʱ��A�����������
C.t2ʱ�̸ı���������������ܱ������м�C
D.�������̴ﵽƽ��ʱ��ƽ�ⳣ��I����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ᴿ���ʵķ�����ȷ���ǣ� ��
A.��ȥHCl��Һ�е�����H2SO4 �� �ɼ�������Ba��NO3��2��Һ�����
B.��ȥ�����е��������ۣ��ɼ�������ϡ��������
C.��ȥFeCl3��Һ�е�����CuCl2 �� �ɼ����������ۺ����
D.��ȥNa2CO3�����е�����NaHCO3 �� �ɽ��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����SO32����Fe2+��Br����I����0.1mol����Һ��ͨ���״���µ�Cl2 �� ͨ��Cl2���������Һ��������ӵ����ʵ����Ĺ�ϵͼ��ȷ���ǣ� ��
A.
B.
C.
D.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£�2L�����ܱ������У�X��Y��Z�������巢����ѧ��Ӧʱ�����ʵ�����ʱ��仯�Ĺ�ϵ������ͼ��ʾ���� 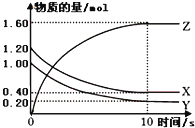
��1���ٷ�Ӧ�Ļ�ѧ����ʽΪ�� ��0��10s�ڣ���Z��ʾ�Ļ�ѧ��Ӧ������
��X��ת����Ϊ��
��2����֪I2��g��Ϊ�Ϻ�ɫ���ں��������У����淴ӦH2��g��+I2��g��2HI��g���ﵽƽ��ı�־�ǣ�������
A.��������ܶȺ㶨����
B.����������ɫ���ٸı�
C.H2��I2��HI��Ũ�����
D.��������ѹǿ���ٸı䣮
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com