
分析 物质导电的条件:存在自由电子或者自由移动的离子;
电解质:在水溶液中或熔融状态下能导电的化合物;例:酸、碱、盐,金属氧化物等.
非电解质:在水溶液中和熔融状态下都不能导电的化合物;例:有机物,非金属氧化物等.
解答 解:①盐酸为混合物,含有自由移动离子,能够导电;既不是电解质,也不是非电解质;
②Cu是单质,含有自由移动电子,能够导电;既不是电解质,也不是非电解质;
③Na2SO4,不含自由电子和自由移动离子,不导电;在水溶液中或熔融状态下能导电,是电解质;
④C(石墨)为单质,含有自由电子,能够导电;既不是电解质,也不是非电解质;
⑤C2H5OH为化合物,不含自由电子和自由移动离子,不导电;在水溶液中和熔融状态下都不能导电,属于非电解质;
⑥食盐水为混合物,含有自由移动离子,能够导电;既不是电解质,也不是非电解质;
⑦CO2,不含自由电子和自由移动离子,不导电;本身不能电离产生自由移动离子,属于非电解质;
⑧MgO,不含有自由电子和自由移动离子,不导电;熔融状态下能够导电,属于电解质;
所以在常温下能够导电的物质是①②④⑥,属于电解质的是③⑧,属于非电解质的是⑤⑦;
故答案为:①②④⑥;③⑧;⑤⑦.
点评 本题考查了电解质、非电解质判断,把握概念是解题关键,注意电解质、非电解质都是化合物,电解质必须是本身能够电离的化合物,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | H2在正极发生氧化反应 | |
| B. | 供电时的总反应为:2H2+O2═2H2O | |
| C. | 氢氧燃料电池中H2和O2燃烧放出的热量转变为电能 | |
| D. | 氢氧燃料电池不属于环境友好电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H6 | B. | C3H4 | C. | C4H6 | D. | C5 H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
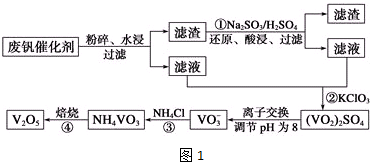
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
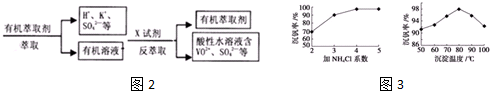
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .A+、C2-、D-中离子半径最小的是Na+.
.A+、C2-、D-中离子半径最小的是Na+. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com