
分析 ①氯气是强氧化剂,和变价金属反应生成高价的化合物;
②铁和稀硫酸反应生成亚硫酸铁和氢气,稀硫酸过量,则溶液中加入KNO3溶液会形成稀硝酸具有氧化性能氧化亚铁离子为铁离子;
③硫单质氧化性弱和变价金属反应生成低价化合物;
④向Fe(NO3)2溶液中加入少量的盐酸,硝酸根离子和氢离子形成稀硝酸,稀硝酸具有强氧化性能氧化亚铁离子;
⑤氧化铁与盐酸反应生成氯化铁,若Fe足量,发生Fe+2Fe3+=3Fe2+.
解答 解:①过量的铁与氯气反应,生成氯化铁,与Fe的过量无关,故①选;
②Fe与过量稀硫酸反应后,生成硫酸亚铁,再向其中加KNO3,发生氧化还原反应生成铁离子,故②选;
③硫单质氧化性弱和变价金属反应生成低价化合物,Fe与过量的S加热时发生反应只能生成FeS,故③不选;
④Fe(NO3)2溶液中加少量盐酸,硝酸根离子和氢离子形成稀硝酸,发生氧化还原反应生成铁离子,故④选;
⑤Fe和Fe2O3的混合物溶于盐酸中,若Fe足量,发生Fe+2Fe3+=3Fe2+,则不含铁离子,故⑤不选;
反应后一定有Fe3+生成的是①②④,
故答案为:①②④.
点评 本题考查铁的化学性质及氧化还原反应,为高频考点,强氧化性物质、弱氧化剂与变价金属反应产物的分析为解答的关键,注意氧化剂的氧化性及硝酸盐在酸性条件下的性质,题目难度不大.


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铁溶于硫酸氢钠溶液中:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | Mg(HCO3)2溶液与过量的NaOH溶液反应:Mg2++HCO3-+OH-═MgCO3↓+H2O | |
| C. | FeI2溶液中通入过量Cl2:2Fe2++4I-+3Cl2═2Fe3++2I2+6Cl- | |
| D. | 从酸化的海带灰浸出液中提取碘:2H++2I-+H2O2═I2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 定容时仰视刻度线 | B. | 转移溶液后未洗涤烧杯和玻璃棒 | ||
| C. | 定容时俯视刻度线 | D. | 移液前容量瓶中有少量蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 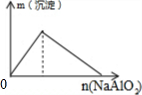 向盐酸中滴入NaAlO2溶液 | B. | 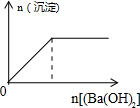 NaHSO4溶液中逐滴加入Ba(OH)2溶液 | ||
| C. | 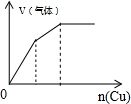 将铜粉加入到一定浓硝酸中 | D. | 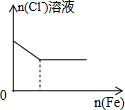 将铁粉加入到一定量氯化铁溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ca2+ | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有$S{O}_{4}^{2-}$ | |
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ | |
| D. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中溶液变浑浊,一定有$C{O}_{3}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | X | Y | Z |
| 初始浓度/mol/L | 0.1 | 0.2 | 0 |
| 平衡浓度/mol/L | 0.05 | 0.05 | 0.1 |
| A. | 前3 min内,用Y的变化量表示的平均反应速率v(Y)=0.05mol•L-1•min-1 | |
| B. | 反应达到平衡时,X的转化率为50% | |
| C. | 增大压强使平衡向生成Z的方向移动,平衡常数增大 | |
| D. | 反应可表示为X+3Y?2Z,其平衡常数为1600 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:
乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:| 温度/℃ | 800 | 1000 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
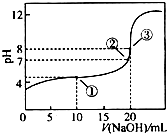 在25℃时,向50.00mL未知浓度的CH3COOH溶液中逐滴加入0.5mol•L-1的NaOH溶液.滴定过程中,溶液的pH与滴入NaOH溶液体积的关系如图所示,则下列说法中,不正确的是( )
在25℃时,向50.00mL未知浓度的CH3COOH溶液中逐滴加入0.5mol•L-1的NaOH溶液.滴定过程中,溶液的pH与滴入NaOH溶液体积的关系如图所示,则下列说法中,不正确的是( )| A. | 该滴定过程可采用酚酞做指示剂 | |
| B. | 图中点③所示溶液中,c(CH3COO-)<c(Na+) | |
| C. | 图中点①所示溶液中水的电离程度大于点③所示溶液中水的电离程度 | |
| D. | 滴定过程中的某点,会有c(Na+)=c(CH3COO-)>c(H+)=c(OH-)的关系存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com