
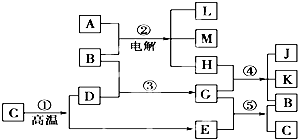
 根据如图反应框图填空,已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应.
根据如图反应框图填空,已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应. 2NaOH+H2↑+Cl2↑,则A为NaCl,产物中只有Cl2能够与Ca(OH)2反应,故H为Cl2,则单质L为H2,
2NaOH+H2↑+Cl2↑,则A为NaCl,产物中只有Cl2能够与Ca(OH)2反应,故H为Cl2,则单质L为H2, 2NaOH+H2↑+Cl2↑,④为制漂白粉的反应,
2NaOH+H2↑+Cl2↑,④为制漂白粉的反应, 2NaOH+H2↑+Cl2↑;2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O;
2NaOH+H2↑+Cl2↑;2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O; 2NaOH+H2↑+Cl2↑,则A为NaCl,产物中只有Cl2能够与Ca(OH)2反应,故H为Cl2,则单质L为H2,④为制漂白粉的反应,
2NaOH+H2↑+Cl2↑,则A为NaCl,产物中只有Cl2能够与Ca(OH)2反应,故H为Cl2,则单质L为H2,④为制漂白粉的反应,

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
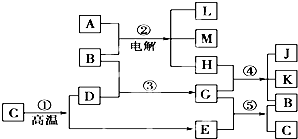
 根据如图反应框图填空,已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应.
根据如图反应框图填空,已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应.
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
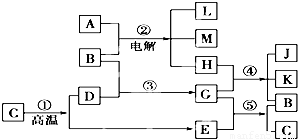
科目:高中化学 来源:2012-2013学年江苏省无锡市江阴市华士中学、成化中学联考高一(上)期中化学试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com