
BaSO4在水中存在沉淀溶解平衡BaSO4(s) Ba2+(aq)+SO42-(aq),溶度积常数Ksp=c(Ba2+)·c(SO42-)。
Ba2+(aq)+SO42-(aq),溶度积常数Ksp=c(Ba2+)·c(SO42-)。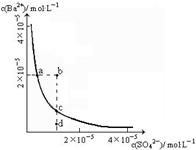
(1)某温度时,BaSO4的沉淀溶解平衡曲线如图所示。下列说法正确的是______
| A.加入Na2SO4可以使溶液由a点变到b点 |
| B.通过蒸发可以使溶液由d点变到c点 |
| C.d点无BaSO4沉淀生成 |
| D.a点对应的Ksp大于c点对应的Ksp |
(1)C
(2)①c(Ba2+)=" 1.1" × 10-5mol·L-1 < 2×10-3 mol·L-1,胃液中H+对BaSO4的沉淀溶解平衡没有 影响,因此BaSO4可用做“钡餐”。
②不能;BaCO3(s) Ba2+(aq)+ CO32-(aq),尽管c(Ba2+)=" 1.0" × 10-4mol·L-1 < 2×10-3 mol·L-1,但由于胃液是酸性的,胃酸可与CO32-反应生成二氧化碳和水,使CO32-的浓度降低,使BaCO3的沉淀溶解平衡向右移动,使Ba2+浓度增大而引起人体中毒。
Ba2+(aq)+ CO32-(aq),尽管c(Ba2+)=" 1.0" × 10-4mol·L-1 < 2×10-3 mol·L-1,但由于胃液是酸性的,胃酸可与CO32-反应生成二氧化碳和水,使CO32-的浓度降低,使BaCO3的沉淀溶解平衡向右移动,使Ba2+浓度增大而引起人体中毒。
解析试题分析:(1)中,在图中线上的点都表示其离子积与Ksp相等,当点在线的上方时,则离子积大于Ksp,则会析出沉淀,当点在线的下方时,则离子积小于Ksp,则沉淀会溶解,不会产生沉淀,故C正确,C不正确;加入Na2SO4不可以使溶液由a点变到b点,因为沉淀或Ba离子的浓度改变了,故A不正确;通过蒸发不可以使溶液由d点变到c点,因为蒸发后,离子的浓度也改变了,故B不正确,所以答案为C。(2)①中,硫酸钡作为“钡餐”的理由是①c(Ba2+)=" 1.1" × 10-5mol·L-1 < 2×10-3 mol·L-1,胃液中H+对BaSO4的沉淀溶解平衡没有 影响,因此BaSO4可用做“钡餐”。②不能用碳酸钡代替硫酸钡作为“钡餐”,原因是BaCO3(s) Ba2+(aq)+ CO32-(aq),尽管c(Ba2+)=" 1.0" × 10-4mol·L-1 < 2×10-3 mol·L-1,但由于胃液是酸性的,胃酸可与CO32-反应生成二氧化碳和水,使CO32-的浓度降低,使BaCO3的沉淀溶解平衡向右移动,使Ba2+浓度增大而引起人体中毒。
Ba2+(aq)+ CO32-(aq),尽管c(Ba2+)=" 1.0" × 10-4mol·L-1 < 2×10-3 mol·L-1,但由于胃液是酸性的,胃酸可与CO32-反应生成二氧化碳和水,使CO32-的浓度降低,使BaCO3的沉淀溶解平衡向右移动,使Ba2+浓度增大而引起人体中毒。
考点:溶度积,平衡的移动
点评:本题考查了溶度积,平衡的移动,是高考的常考题型,本题有一定的综合型,有一定的难度。


科目:高中化学 来源: 题型:阅读理解
 BaSO4在水中存在沉淀溶解平衡BaSO4(s)═Ba2+(aq)+SO42-(aq),溶度积常数Ksp=c(Ba2+)?c(SO42-).
BaSO4在水中存在沉淀溶解平衡BaSO4(s)═Ba2+(aq)+SO42-(aq),溶度积常数Ksp=c(Ba2+)?c(SO42-).查看答案和解析>>
科目:高中化学 来源:2014届江苏省宿迁市高二下学期期中考化学卷(解析版) 题型:填空题
BaSO4在水中存在沉淀溶解平衡BaSO4(s) Ba2+(aq)+SO42-(aq),溶度积常数Ksp=c(Ba2+)·c(SO42-)。
Ba2+(aq)+SO42-(aq),溶度积常数Ksp=c(Ba2+)·c(SO42-)。
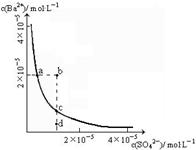
(1)某温度时,BaSO4的沉淀溶解平衡曲线如图所示。下列说法正确的是______
A.加入Na2SO4可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
(2)在胃部透视时,服用的“钡餐”的主要成分是硫酸钡。在25℃时,硫酸钡的溶度积常数约为1.21×10—10。
①Ba2+是一种有毒的重金属离子,当人体中c(Ba2+)达到2×10—3mol·L-1时,就会对健康产生危害。硫酸钡作为“钡餐”的理由 。
②在25℃时,1L水中约能溶解0.0197g碳酸钡,且胃液是酸性的, (填“能”或“不能”)用碳酸钡代替硫酸钡作为“钡餐”,理由是
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:2008-2009学年江苏省泰州市高二(下)期末化学试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com