
| A. | 硝酸钾溶于水 | |
| B. | 氨气和氯化氢反应生成氯化铵晶体 | |
| C. | 水蒸气凝结为液态的水 | |
| D. | (NH4)2CO3分解生成二氧化碳、氨气和水 |
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| B. | Y分别与Z、W形成的化合物中化学键类型相同 | |
| C. | X的最高价氧化物对应的水化物的酸性比W的强 | |
| D. | W的单质可用于制造光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡是分子组成相差一个或几个“CH2”原子团的物质,彼此一定是同系物 | |
| B. | 两种化合物的组成元素相同,各元素质量分数也相同,则两者一定是同分异构体 | |
| C. | 凡是含碳元素的化合物都属于有机化合物 | |
| D. | 有机化合物的同分异构现象是有机化合物种类繁多的重要原因之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 →CH≡C-CH═CH2
→CH≡C-CH═CH2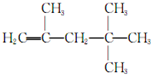 ,它是由不饱和烃乙的两个分子在一定条件下自身加成而得到的.在此反应中除生成甲外,同时还得到另一种产量更多的有机物丙,其最长的碳链仍为5个碳原子,丙是甲的同分异构体.则乙的结构简式是
,它是由不饱和烃乙的两个分子在一定条件下自身加成而得到的.在此反应中除生成甲外,同时还得到另一种产量更多的有机物丙,其最长的碳链仍为5个碳原子,丙是甲的同分异构体.则乙的结构简式是 ,丙的结构简式是
,丙的结构简式是 .
.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:3 | B. | 1:3 | C. | 1:1 | D. | 1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)某催化剂可将汽车尾气中的CO、NO转化为无毒气体.已知:
(1)某催化剂可将汽车尾气中的CO、NO转化为无毒气体.已知:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学小组设计实验元素周期表中元素的性质,请回答下列问题
某化学小组设计实验元素周期表中元素的性质,请回答下列问题查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com