
| A. | 20g | B. | 25.4g | C. | 31.6g | D. | 34.8g |
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:解答题

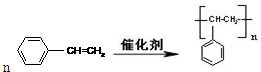 .
.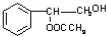 或
或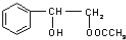 .
.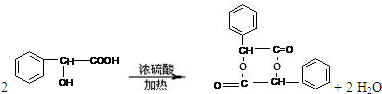 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点:Na>Al | B. | 热稳定性NaHCO3>Na2CO3 | ||
| C. | 酸性:H2CO3>H2SiO3 | D. | 氧化性Br2>Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al的第一电离能逐渐增大 | B. | V、Cr、Mn的最外层电子数逐渐增大 | ||
| C. | S2-、Cl-、K+的半径逐渐减小 | D. | O、F、Ne的电负性逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量 | B. | 原子总数 | C. | 密度 | D. | 分子总数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | 质量(g) | 摩尔质量(g/mol) |
| 蔗糖(C12H22O11) | 25.00 | 342 |
| 硫酸钾 | 0.25 | 174 |
| 阿司匹林(C9H8O4) | 0.17 | 180 |
| 高锰酸钾 | 0.25 | 158 |
| 硝酸银 | 0.02 | 170 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
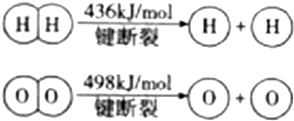
| A. | 该反应原理可用于设计氢氧燃料电池 | |
| B. | 破坏1mol H-O键需要的能量是926.8kJ | |
| C. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+241.8kJ/mol | |
| D. | H2(g)中的H-H键比H2O(g)中的H-O键能小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某吸热反应能自发进行,因此该反应是熵增反应 | |
| B. | NH4F 水溶液中含有 HF,因此 NH4F 溶液不能存放于玻璃试剂瓶中 | |
| C. | 可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底 | |
| D. | 增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成 H2 的速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com