
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
运用化学反应原理研究卤族元素的有关性质具有重要意义。
(1)下列关于氯水的叙述正确的是________(填序号)。
a.氯水中存在两种电离平衡
b.向氯水中通入SO2,其漂白性增强
c.向氯水中通入氯气,c(H+)/c(ClO-)减小
d.加水稀释氯水,溶液中的所有离子浓度均减小
e.加水稀释氯水,水的电离平衡向正反应方向移动
f.向氯水中加少量NaOH固体,可能有c(Na+)=c(Cl-)+c(ClO-)
(2)氯气在工业上有着极其广泛的用途。工业上通过氯碱工业生产氯气,其反应的离子方程式为________________________________。室温下,用惰性电极电解100 mL饱和食盐水,当阴极产生标准状况下11.2 mL气体,忽略溶液体积的变化时,所得溶液的pH=______。
(3)常温下,已知25 ℃时有关弱酸的电离常数:
| 弱酸化学式 | HClO | H2CO3 |
| 电离常数 | K=4.7×10-8 | K1=4.3×10-7, K2=5.6×10-11 |
写出84消毒液(主要成分为NaClO)露置在空气中发生反应的有关化学方程式________________________________________________________________________。
若将84消毒液与洁厕剂(含有浓盐酸)混合使用可能会导致中毒,请用离子方程式解释有关原因________________________________________________________________________
________________________________________________________________________。
(4)服用含碘化钾的碘药片可抗核辐射。将碘药片剥去糖衣皮研碎后置于试管中制得无色水溶液,并加入几滴淀粉试液,然后向试管中逐滴加入氯水,观察到溶液由无色变为蓝色,若继续滴加氯水后蓝色溶液又褪为无色。完成并配平溶液由蓝色变为无色的化学反应方程式(如果化学计量数是1,不用填写):______+______+______—→______HIO3+______。
查看答案和解析>>
科目:高中化学 来源: 题型:
T℃时,在V L恒容密闭容器中加入足量的TaS2(s)和1 mol I2(g),发生反应TaS2(s)+2I2(g)TaI4(g)+S2(g) ΔH>0。t min时生成0.1 mol TaI4。下列说法中正确的是( )
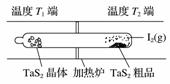
A.0~t min内,v(I2)=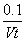 mol· L-1·min -1
mol· L-1·min -1
B.若T ℃时反应的平衡常数K=1,则平衡时I2的转化率为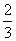
C.图中制备TaS2晶体过程中循环使用的物质是S2(g)
D.图中T1端得到纯净TaS2晶体,则温度T1>T2
查看答案和解析>>
科目:高中化学 来源: 题型:
元素A的各级电离能数据如下:
| I1 | I2 | I3 | I4 | I5 | I6 | |
| I/kJ·mol-1 | 578 | 1 817 | 2 745 | 11 578 | 14 831 | 18 378 |
则元素A的常见价态是( )
A.+1 B.+2 C.+3 D.+6
查看答案和解析>>
科目:高中化学 来源: 题型:
已知Zn2+的4s和4p轨道可以形成sp3型杂化轨道,那么[ZnCl4]2-的空间构型为( )
A.直线形 B.平面正方形
C.正四面体形 D.正八面体形
查看答案和解析>>
科目:高中化学 来源: 题型:
下列现象的变化与配合物的形成无关的是( )
A.向FeCl3溶液中滴加KSCN,出现红色
B.向Cu与Cl2反应的集气瓶中加入少量H2O,呈绿色,再加水,呈蓝色
C.向FeCl2溶液中滴加氯水,溶液颜色变深
D.向AlCl3溶液中逐滴加入NH3·H2O溶液至过量,出现白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组中的两种物质:
①HI和HBr ②CF4和CH4 ③PCl3和NF3 ④N2和H2 ⑤ICl和Br2 ⑥NO和N2 ⑦正丁烷和异丁烷,它们的熔、沸点前者高于后者的是( )
A.只有①②③④ B.只有⑤⑥⑦
C.都是 D.都不是
查看答案和解析>>
科目:高中化学 来源: 题型:
答案 CO 断开CO分子的第一个化学键所需要的能量(273.0 kJ·mol-1)比断开N2分子的第一个化学键所需要的能量(523.3 kJ·mol-1)小
解析 由断开CO分子的第一个化学键所需要的能量[(1 071.9-798.9) kJ·mol-1=273.0 kJ·mol-1]比断开N2分子的第一个化学键所需要的能量[(941.7-418.4) kJ·mol-1=523.3 kJ·mol-1]小,可知CO相对更活泼。
★ ★★
查看答案和解析>>
科目:高中化学 来源: 题型:
N、O、Si、S是重要的非金属元素,下列说法正确的是( )
A.N、O、S、Si的原子半径逐渐增大,非金属性逐渐减弱
B.氮的氧化物和硫的氧化物既是形成光化学烟雾,又是形成酸雨的主要物质
C.汽车尾气中排放的氮氧化合物主要是由游离态氮转化来的
D.N、Si、S的单质均能和氧气反应,生成的产物分别是NO2、SiO2和SO2
★ ★★
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com