
Ⅰ. A、B、C、D、E、F、G七种元素,试按下列所给条件推断,
①A、B、C是同一周期的金属元素,原子核外有三个电子层,A的原子半径在所属周期中最大,且原子半径A>B>C;
②D、E是非金属元素,它们跟氢气化合可生成气态氢化物HD和HE,室温时,D的单质是液体,E的单质是固体
③F在常温下是气体,性质稳定,是除氢气外最轻的气体
④G是除氢外原子半径最小的元素
(1)A 的名称是 ,B位于周期表中第 周期第 族。
(2)C的原子结构示意图是 ,
A元素与D元素形成化合物的电子式是 。
(3)F的元素符号是 。
(4)在上述七种元素中,最高价氧化物对应的水化物碱性最强的化学式是 ,酸性最强的化学式是 ,气态氢化物最稳定的化学式是 。
(5)将C的氧化物对应的水化物投入到A的氧化物对应的水化物中,反应的化学方程式是
。
Ⅱ、(1)下表中的实线表示元素周期表部分边界,请用实线画出周期表未完成的边界及金属元素与非金属元素的分界线。
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
(1)钠(1分) 三 ⅡA (1分)
(2)铝原子结构示意图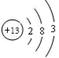 (1分)溴化钠电子式
(1分)溴化钠电子式 (1分)
(1分)
(3)He (1分)
(4) NaOH (1分) HBrO4 (1分) HF (1分)
(5)Al(OH)3+NaOH =NaAlO2+2H2O (3分)
Ⅱ、边界(1分)分界线(1分) F(1分) Cs(1分)
解析试题分析:在同周期中,原子半径随原子序数的增大而减小。据题意可知A为钠B为镁C为铝。由室温时,D的单质是液体,E的单质是固体可知D为溴、E为硫.由F在常温下是气体,性质稳定,是除氢气外最轻的气体可知F应为氦。由G是除氢外原子半径最小的元素可知G应为氟。
考点:考查元素周期表相关知识的应用


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:单选题
1907年2月2日,享誉世界的俄国化学家门捷列夫因心肌梗塞与世长辞,那一天距离他的73岁生日只有六天。门捷列夫在科学界的主要贡献是
| A.发现色盲现象 | B.发现元素周期律 |
| C.发明硝酸甘油炸药 | D.发现了放射性元素钋 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(18分)(1)按已知的原子结构规律,82号元素X应是第___________周期_________族元素,它的最高正价氧化物的化学式为______________。
(2)以下反应:①木炭与水制备水煤气 ②氯酸钾分解 ③炸药爆炸 ④酸与碱的中和反应 ⑤生石灰与水作用制熟石灰 ⑥ Ba(OH)2·8H2O与NH4Cl,属于放热反应_____________填序号),写出反应⑥的化学方程式__ ____。
(3)在下列化合物中:H2O2 、Na2O、、I2 、、NaCl、、CO2、NH4Cl、Na2O2,用化学式回答下列问题:
①只由非金属组成的离子化合物是 ,②只有极性共价键的共价化合物是 ,
③只含有非极性共价键的是 ,④既有离子键又有非极性键的化合物是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(5分)短周期元素X、Y、Z、W核电荷数依次增大,X、Z同主族,Z、W同周期,四种元素的原子序数之和为37,在周期表中X是原子半径最小的元素,Y的最外层电子数是内层电子数的3倍。
(1)W在周期表中的位置是 。
(2)X与Y 能形成具有18个电子的化合物,此化合物的电子式为 。
(3)X、Y、Z三种元素组成的化合物中存在的化学键类型为 。
(4)Z、W两种元素的最高价氧化物对应水化物溶液之间反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12分)A、B、C、D、E五种短周期元素,其原子序数依次增大,而原子半径按A、C、B、E、D顺序依次增大。A、D同主族;B、D、E三种元素原子的最外层电子数之和为10;E的单质可做半导体材料;C与E两元素形成的化合物可与A、C、D形成的化合物Y发生反应;B元素的气态氢化物与其最高价氧化物的水化物可以发生反应生成化合物M。1molM中含有42mol电子。回答下列问题:
(1)E元素在周期表中的位置 ;化合物M中含有的化学键类型有
(2)比较B、C、E形成的气态氢化物的稳定性由强到弱的顺序是(用化学式表示): ;写出C与A形成的18e-化合物的电子式 ;
(3)用电子式表示A2C的形成过程:
(4)写出题中生成M的化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用化学用语回答下列问题:
(1)已知由①、③、④三种元素组成的某种常见化合物的水溶液呈酸性,则符合该条件的化合物的化学式可能为 (至少写两种)。
(2)由表中①、④两种元素按原子个数比为1∶1构成的化合物的稀溶液易被催化分解,通常使用的催化剂为 (填序号)。
a. MnO2 b. FeCl3 c、Na2SO3 d、KMnO4
(3)下图中A~F是由部分上表中元素组成的单质或化合物,其中A、B、C为单质,转化关系如下:
Ⅰ.若B为黄色固体,A为原子半径最小的原子组成的单质。
①F的电子式为 。
②实验测得起始参加反应的B和最后生成的B质量相等,则起始参加反应的A和C的物质的量之比是 。
Ⅱ.若D为淡黄色固体,焰色反应为黄色,组成C的元素的原子最外层电子数是内层电子数的2倍。
①下列关于D的说法正确的是 (填字母)。
a.能与水发生化合反应 b.既有氧化性,又有还原性
c.既含离子键,又含非极性共价键 d.是一种碱性氧化物
②用惰性电极将F的饱和溶液进行电解,则阳极反应式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
M是原子序数<30的一种金属,常用于航空、宇航、电器及仪表等工业部门,M原子的最外层有空轨道,且有两个能级处于电子半充满状态。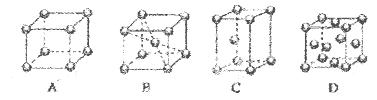
(1)M原子的外围电子排布式为_______________,在周期表中属于___________区元素。
(2)M的堆积方式属于钾型,其晶胞示意图为____(填序号)。其空间利用率为____。
(3) MCl3?6H2O有三种不同颜色的异构体
A、[M(H2O)6]Cl3,B、[M(H2O)5Cl]Cl2?H2O和C、[M(H2O)4Cl2]Cl?2H2O
为测定蒸发MCl3溶液析出的暗绿色晶体是哪种异构体,取0.10molMCl3·6H2O 配成溶液,滴加足量AgNO3溶液,得到沉淀2.870 g。该异构体为___________(填A或B或C)。
(4)常温下为暗红色液体,熔点-96. 5℃,沸点117℃,能与丙酮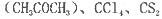 等互溶。
等互溶。
①固态MO2Cl2属于___________晶体;
②中碳原子和丙酮(CH3COCH3)羰基中的碳原子分别采取的杂化方式为______杂化和_____杂化。
(5)+3价M的配合物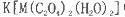 中,配体是___________,与C2O42-互为等电子体的分子是(填化学式)_______________。
中,配体是___________,与C2O42-互为等电子体的分子是(填化学式)_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(9分)A、X、Y、Z和W是原子序数依次增大的五种短周期元素。A和X可组成两种常温下为液态的化合物A2X、A2X2,X和Y也可组成两种常温下为固态的化合物Y2X、Y2X2,且Y2X、Y2X2的焰色反应均为黄色。在元素周期表中,A与Y同主族,X与Z同主族,Z与W相邻。请同答:
(1)A2X2的结构式 ,Y2X2的电子式 。
(2)X、Z两种元素的氢化物中熔沸点较高的是 (填化学式,下同);工业上将Z的低价氧化物转化为高价氧化物的化学方程式为 。
(3)W元素在周期表中的位置为 ;实验室制备W单质的化学反应方程式为 ;在上述反应中氧化剂和还原剂的物质的量比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
【化学-选修3物质结构与性质】(15分)
请回答以下问题:
(1)第四周期的某主族元素,其第一至五电离能数据如下图1所示,则该元素对应原子的M层电子排布式为 .
(2)如下图2所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是 .简述你的判断依据 .
(3)CO2在高温高压下所形成的晶体其晶胞如下图3所示.该晶体的类型属于 (选填“分子”“原子”“离子”或“金属”)晶体,该晶体中碳原子轨道的杂化类型为 。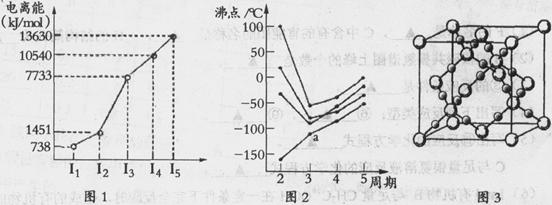
(4)在离子晶体中正、负离子间力求尽可能多的接触,以降低体系的能量,使晶体稳定存在。已知Na+半径是Cl-的a倍,Cs+半径是Cl-的b倍,请回顾课本上NaCl和CsCl的晶胞,其晶胞边长比为 .
(5)Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的A-D图中正确的是 .铁原子的配位数是 ,假设铁原子的半径是r cm,该晶体的密度是p g/cm3,则铁的相对原子质量为 (设阿伏加德罗常数的值为NA)。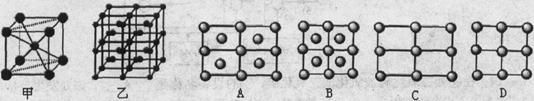 、
、
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com