
【题目】常温时,0.01 mol·L-1某一元弱酸的电离常数Ka=10-6,则下列说法正确的是
A. 上述弱酸溶液的pH=4
B. 加入NaOH溶液后,弱酸的电离平衡向右移动,K值增大
C. 加入等体积0.01 mol·L-1NaOH溶液后,所得溶液的pH=7
D. 加入等体积0.01 mol·L-1NaOH溶液后,所得溶液的pH<7
科目:高中化学 来源: 题型:
【题目】工业上由黄铜矿(主要成分CuFeS2,质量分数为90%)冶炼铜的主要流程如下:

己知:一定条件下,铝可以和某些金属氧化物反应置换金属
(1)高温焙烧前要将黄铜矿粉碎的目的是_________________。
(2)气体A中的大气污染物可选用下列试剂中的____________吸收。
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(3)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在____(填离子符号),欲检验溶液中还存在Fe2+,所需试剂是_________。
(4)由泡铜冶炼粗铜的化学反应方程式为_________。
(5)某同学用铜、稀硫酸和H2O2制备CuSO4溶液,其化学反应方程式为_________,反应停止后除去溶液中过量的H2O2的简便方法是_____________。
(6)1.15吨该黄铜矿理论上可以得到含杂质10%的粗铜质量为_________kg(冶炼过程中铜损失忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组制备氢氧化亚铁沉淀。
实验1 |
| 实验现象 |
液面上方产生白色絮状沉淀,迅速变为灰绿色,振荡,试管壁上有红褐色沉淀生成。 |
(1)实验1中产生白色沉淀的离子方程式是________________。
(2)为了探究沉淀变灰绿色的原因,该小组同学展开如下探究:
① 甲同学推测灰绿色物质为Fe(OH)2和Fe(OH)3混合物。查阅资料后根据调色原理认为白色和红褐色的调和色不可能是灰绿色,并设计实验证实灰绿色物质中不含有 Fe(OH)3,方案是__________。
② 乙同学查阅文献:Fe(OH)2在大量SO42存在的情况下形成Fe6(SO4)2(OH)4O3(一种氧基碱式复盐)。并设计对比实验证实该假设:向试管中加入_____________,再往试管中加入____________,振荡,现象与实验1相同,结论是该假设不成立。
③ 乙同学继续查阅文献:Fe(OH)2沉淀具有较强的吸附性能,灰绿色可能是由Fe(OH)2表面吸附Fe2+引起。推测所用的硫酸亚铁溶液的浓度应越小越好;氢氧化钠溶液浓度应越大越好。设计了如下实验方案:
试管中10 mL NaOH溶液 | 滴加 FeSO4溶液 | 实验现象 | |
实验2 | 6 mol/L NaOH溶液 | 0.2mol/L FeSO4溶液 | 产生悬浮于液面的白色沉淀(带有少量灰绿色) ,沉淀下沉后,大部分灰绿色变为白色沉淀 |
实验3 | 6 mol/L NaOH溶液 | 0.1mol/L FeSO4溶液 | 产生悬浮于液面的白色沉淀(带有极少量灰绿色) ,沉淀下沉后,底部都为白色沉淀 |
该实验得出的结论是_______________,能说明灰绿色是由Fe(OH)2表面吸附Fe2+引起的证据是____________。丙同学认为该实验方案不足以证明灰绿色是由Fe(OH)2表面吸附Fe2+引起的,还需补充的实验是________________,证明该假设成立。
(3)丙同学探究温度对氢氧化亚铁制备实验的影响:取少量灰绿色沉淀,在水浴中加热,颜色由灰绿变白,且有絮状白色沉淀下沉,原因为_____________。
(4)根据以上实验探究,若尽可能制得白色Fe(OH)2沉淀,需要控制的实验条件____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.锌粒与稀盐酸反应:Zn+2H+=Zn2++H2↑
B.溴化钠溶液与氯气反应:Br﹣+Cl2=Cl﹣+Br2
C.氢氧化铜与稀硫酸反应:OH﹣+H+=H2O
D.钠与水反应:Na++2H2O=Na++2OH﹣+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油裂解气用途广泛,由石油裂解气合成生物可降解高聚物J的合成线路如下:
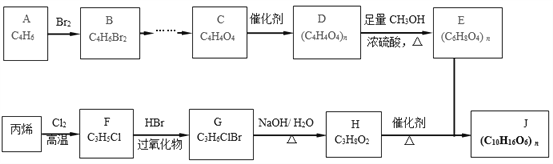
已知:
i.酯与酯可发生如下酯交换反应:RCOOR'+R"OH![]() RCOOR"+R'OH(R、R'、R"代表烃基)
RCOOR"+R'OH(R、R'、R"代表烃基)
ii.烯烃中,碳碳双键相邻为不稳定结构,碳碳双键易被氧化剂氧化。
(1)A为链状烃,其核磁共振氢谱中有两组峰且面积之比是1:2,则A的名称为____________。
(2)B 中所含官能团名称为____________ 。
(3)C→D的反应类型 ______________。
(4)C能与足量的 NaHCO3 溶液反应生成C4H2O4Na2, C的结构简式为_______________。
(5)D→E的化学方程式是 ______________。
(6)H中不含甲基,H与E形成对称型高聚物J的化学方程式是______________。
(7)请完成 B → C 的合理路线________________ 。( 无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于萃取的理解,下列说法正确的是( )
A.可以用四氯化碳把溴水中的溴萃取出来,静置分层后,上层呈橙红色
B.可以用酒精萃取碘水中的碘
C.可以用水做萃取剂把碘从四氯化碳溶液中分离出来
D.萃取之后一般通过分液的方法将互不相溶的液体分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.用直接加热氧化铝的方法冶炼得到铝
B.海水中含有钾元素,只需经过物理变化可以得到钾单质
C.从海水中可以得到NaCl,电解熔融NaCl可制备Cl2
D.高炉炼铁的过程是通过置换反应得到铁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com