
分析 (1)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
(2)分析操作对溶质的物质的量和溶液体积的影响,依据c=$\frac{n}{V}$进行误差分析;
(3)CO2与NaOH溶液反应有如下情况:
若n(NaOH):n(CO2)≥2,发生反应:CO2+2NaOH=Na2CO3+H2O,得到产物只有碳酸钠;
若n(NaOH):n(CO2)≤1,发生反应:CO2+NaOH=NaHCO3,得到产物只有碳酸氢钠;
若1<n(NaOH):n(CO2)<2,发生反应:CO2+2NaOH=Na2CO3+H2O,CO2+Na2CO3+H2O=2NaHCO3,产物为碳酸钠和碳酸氢钠的混合物.
解答 解:(1)配制一定物质的量浓度溶液的一般步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶可知所需的仪器为:托盘天平、烧杯、玻璃棒、100mL容量瓶、胶头滴管,还缺少的玻璃仪器:100mL容量瓶、胶头滴管;
故答案为:100mL容量瓶、胶头滴管;
(2)①NaOH固体溶解后立即转移至容量瓶,冷却后,溶液体积偏小,溶液浓度偏高;
故答案为:偏高;
②定容时,俯视刻度线,导致溶液体积偏小,溶液浓度偏高;
故答案为:偏高;
(3)100mL的2mol/L的NaOH溶液含有氢氧化钠溶质物质的量为0.1L×2mol/L=0.2mol,标况下的3.36L的CO2气体物质的量为$\frac{3.36L}{22.4L/mol}$=0.15mol,若1<n(NaOH):n(CO2)=$\frac{4}{3}$<2,所以产物为碳酸钠和碳酸氢钠混合物,令溶液中Na2CO3、NaHCO3的物质的量分别为amol、bmol,则:
根据钠元素守恒有2a+b=0.2
根据碳元素守恒有a+b=0.15
联立解得:a=0.05,b=0.1;
所以溶液中含有0.05molNa2CO3;0.1molNaHCO3;
故答案为:0.05molNa2CO3;0.1molNaHCO3.
点评 本题考查了一定物质的量浓度溶液的配制及有关方程式的计算,明确配制原理,准确判断发生的反应是解题的关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
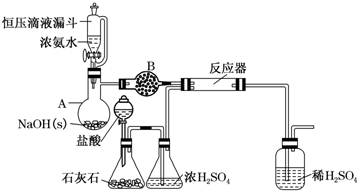
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物的光合作用使得太阳能转化为化学能 | |
| B. | 人类使用照明设备是将电能转化为光能 | |
| C. | 化学键的断裂和形成是化学反应中能量变化的主要原因 | |
| D. | 燃料燃烧时只是将化学能转化为热能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑥ | B. | ①②⑤⑥ | C. | ②③④⑥ | D. | ③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
. ,这种化合物中所含的化学键类型有离子键、共价键.
,这种化合物中所含的化学键类型有离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
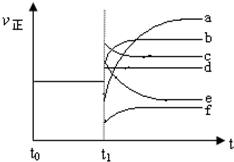 水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:| 容器编号 | c(H2O)/mol•L-1 | c(CO)/mol•L-1 | c(H2)/mol•L-1 | ν正、ν逆比较 |
| I | 0.06 | 0.60 | 0.10 | ν正=ν逆 |
| Ⅱ | 0.12 | 0.20 | 0.60① | ν正=ν逆 |
| Ⅲ | 0.10 | 0.20 | 0.40 | ν正_②>ν逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com